2020山东高三下学期鲁科版高中化学高考模拟
| 1. | 详细信息 |
|
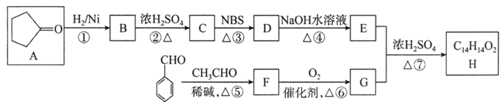
有机化合物H是一种治疗心血管疾病药物的中间体。一种合成H的路线:
已知:信息① CH3CH2CH=CH2 信息② 回答下列问题: (1)C的化学名称为________________,D中的官能团名称是__________________。 (2)②的反应类型是______________________________________。 (3)F的结构简式为______________________________________。 (4)写出由E和G生成H的化学方程式:__________________________________________。 (5)芳香族化合物Q是H的同分异构体,一定条件下,H和Q分别与足量H2加成,得到同一种产物,则Q的可能结构有________种(环中没有碳碳叁键,也没有连续的碳碳双键,不考虑立体结构),其中分子内存在碳碳叁键的同分异构体的结构简式为______________。 (6)呋喃丙烯酸(
|
|
| 2. | 详细信息 | ||||||||||||
|
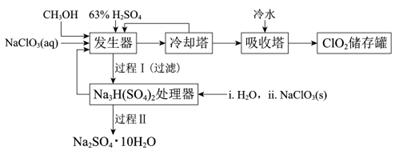
二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O b.相关物质的熔沸点:
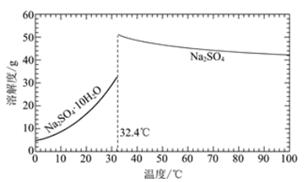
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。 (2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。 A.0~10℃ B.20~30℃ C.60~70℃ (3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。 已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。 ②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。 ③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
|
|||||||||||||
| 3. | 详细信息 |
|
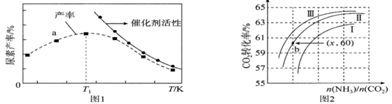
氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。 (1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下: 反应I: 反应Ⅱ: 反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1 则反应: (2)将氨气与二氧化碳在有催化剂的反应器中反应
①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。 ②实际生产中,原料气带有水蒸气,图2表示CO2 ③已知该反应的 (3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
①25℃时,向N2H4水溶液中加入H2SO4,欲使 ②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
|
|
| 4. | 详细信息 |
|
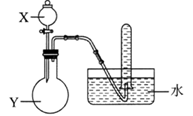
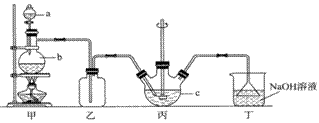
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”。已知它易溶于水,难溶于乙醇,在中性或碱性环境中稳定,受热、遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
(1)装置甲中,a仪器的名称是____________;a中盛有浓硫酸,b中盛有亚硫酸钠,实验中要控制SO2生成速率,可以采取的措施有_________________________(写出一条即可)。 (2)装置乙的作用是____________________________________。 (3)装置丙中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为:________________________________________。 (4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为_________。(实验中供选用的试剂及仪器:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管.提示:室温时CaCO3饱和溶液的pH=9.5) (5)反应结束后过滤丙中的混合物,滤液经蒸发、结晶、过滤、洗涤、干燥等得到产品,生成的硫代硫酸钠粗品可用_____________洗涤。为了测定粗产品中Na2S2O3·5H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应)。称取1.50g粗产品溶于水,用0.20 mol·L-1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中 ①写出反应的离子方程式:________________________________________。 ②产品中Na2S2O3·5H2O的质量分数为____________________(保留小数点后一位)。
|
|
| 5. | 详细信息 |
|
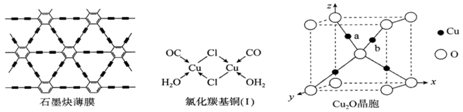
铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。 (1)基态铜原子核外有________对自旋相反的电子。 (2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________I1(Pb)(填“大于”或“小于”)。 (3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________; (4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________的杂化方式。
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________σ键数目。 (6)Cu2O可用于半导体材料。 ①Cu2O晶胞(如图所示)中,O原子的配位数为________________;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________。 ②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________(填“高”或“低”),请解释原因___________________。
|
|
| 6. | 详细信息 |
|
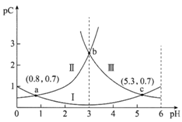
常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
A. 常温下,H2C2O4的Ka1=100.8 B. pH=3时,溶液中 C. pH由0.8增大到5.3的过程中,水的电离程度逐渐增大 D. 常温下,随着pH的增大,
|
|
| 7. | 详细信息 | ||||||||||||||||||||
|
下列“实验现象”和“结论”都正确且有因果关系的是
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 8. | 详细信息 |
|
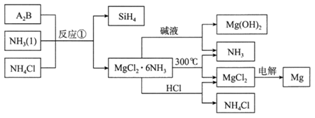
图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
A. A2B的化学式为Mg2Si B. 该流程中可以循环使用的物质是NH3和NH4Cl C. 利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应 D. 分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
|
|
| 9. | 详细信息 |
|
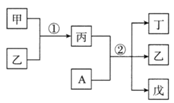
短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
A. 简单离子半径:c>b B. 丙中既有离子键又有极性键 C. b、c形成的化合物中阴、阳离子数目比为1:2 D. a、b、d形成的化合物中,d的杂化方式是sp3
|
|
| 10. | 详细信息 |
|
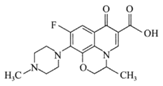
氧氟沙星是常用抗菌药物,其结构简式如图所示。下列有关氧氟沙星的叙述错误的是
A. 能发生加成、取代、还原等反应 B. 分子内有3个手性碳原子 C. 分子内存在三种含氧官能团 D. 分子内共平面的碳原子多于6个
|
|
| 11. | 详细信息 |
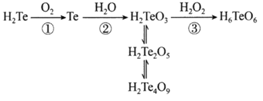
|
含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是
A. 反应①利用了H2Te的还原性 B. 反应②中H2O作氧化剂 C. 反应③利用了H2O2的氧化性 D. H2Te2O5转化为H2Te4O9发生了氧化还原反应
|
|
| 12. | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A. 标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为 B. 20gD2O与20gH218O含有的中子数均为10NA C. 1mol·L-1Al(NO3)3溶液中含有3NA个NO3- D. 50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
|
|
| 13. | 详细信息 |
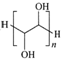
|
相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成( A. 环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇 B. 聚乙二醇的结构简式为 C. 相对分子质量约为4000的聚乙二醇的聚合度n≈67 D. 聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
|
|
| 14. | 详细信息 |
|
硒(Se)元素是人体必需的微量元素之一。下列说法正确的是 A. 硒的摄入量越多对人体健康越好 B. SeO32-空间构型为正四面体 C. H2Se的熔沸点比H2S高 D. H2SeO4的酸性比H2SO4强
|
|
| 15. | 详细信息 |
|
下列关于蛋白质的叙述不正确的是 A.鸡蛋黄的主要成分是蛋白质 B.鸡蛋白遇硝酸变黄色 C.鸡蛋白炒糊时有烧焦羽毛的气味 D.蛋白质水解的最终产物是氨基酸 |
|
| 16. | 详细信息 | ||||||||||
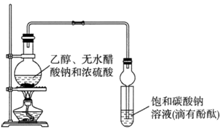
|
某课外活动小组设计如图所示装置制取较多量乙酸乙酯。已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。 ②有关有机物的沸点:
下列说法正确的是
A. 装置中球形管既能冷凝蒸气又能防止倒吸 B. 反应结束后大试管中的现象是:溶液分层,下层无色油状液体;上层溶液颜色变浅 C. 从大试管中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出乙醇 D. 最后加入无水硫酸钠,然后进行蒸馏,收集118℃左右的馏分,以得到较纯净的乙酸乙酯。
|
|||||||||||
| 17. | 详细信息 |
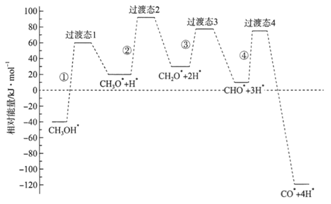
|
科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是
A. ②中包含C—H键的断裂过程 B. 该历程中能垒(反应活化能)最小的是③ C. 该历程中制约反应速率的方程式为CH3O*+3H* D. 由此历程可知:
|
|
| 18. | 详细信息 |
|
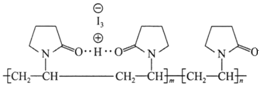
“碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图所示。下列说法正确的是
A. C、N、O原子的电负性依次增大 B. 聚维酮碘中含有离子键、共价键、氢键等化学键 C. 聚维酮易溶于水的原因是与水分子间形成氢键 D. 分子中的含N五元环一定是平面结构
|
|
| 19. | 详细信息 | ||||||||||||||||||||
|
用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 20. | 详细信息 |
|
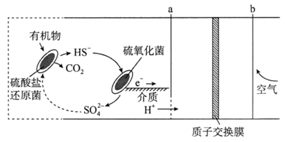
微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法错误的是
A. b电极发生还原反应:4H++O2+4e-=2H2O B. 电路中有4mol电子发生转移,大约消耗标准状况下22.4L空气 C. 维持两种细菌存在,该装置才能持续将有机物氧化成CO2并产生电子 D. HS-在硫氧化菌作用下转化为
|
|
 (
(