2018河北高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列图示中,由其他能量主要转换为化学能的是
|
|
| 2. | 详细信息 |
|
下列过程中吸收能量的是 A.冰雪消融 B.酸碱中和 C.稀释浓硫酸 D.钾投入水中
|
|
| 3. | 详细信息 |
|
下列对科学家的相关成果的说法正确的是 A.屠呦呦发现抗疟新药青蒿素(C15H22O5) ,青蒿素属于有机物 B.闵恩泽研发重油裂解催化剂,催化裂解是为了得到更多质量更好的石油 C.凯库勒确立了苯环的结构,苯环是碳碳单键和碳碳双键交替的结构 D.门捷列夫发现了元素周期律,元素的性质一定随相对原子质量的改变呈周期性变化
|
|
| 4. | 详细信息 |
|
.美国GPS采用了铯原子钟和铷原子钟结合的方式,我国北斗三号组网卫星使用的是先进氢钟和铷钟。下列有关氢铷(Rb)、铯(Cs)的说法错误的是 A.H、Rb、Cs均位于第IA族 B.H、Rb、Cs的最高正价均为+1 C.Rb、Cs与水的反应均比K与水的反应更剧烈 D.Rb单质的熔点比Cs的低
|
|
| 5. | 详细信息 |
|
化学与生产、生活密切相关。下列说法错误的是 A.夏季食品放在冰箱中可延长食品的保存期限 B.为延长锂电池的使用寿命,应将锂电池靠近火源及其他热源 C.天然气中常掺入少量有特殊气味的杂质气体,用以警示气体的泄漏 D.碳素钢制炊具用完后立即洗净、擦干,可以有效地防止其生锈
|
|
| 6. | 详细信息 |
|
海洋是卤素资源的宝库,下列有关卤素的说法正确的是 A.原子半径:F>Cl>Br>I B.单质的沸点:F2>Cl2>Br2>I2 C.酸性:HF>HCl>HBr>HI D.单质的氧化性:F2>Cl2>Br2>I2
|
|
| 7. | 详细信息 |
|
下列化学用语表示正确的是 A.聚乙烯的结构简式: C HCl的形成过程: D. 丙烯与溴的四氯化碳溶液反应:CH3CH=CH2+Br2→CH3CH2CHBr2
|
|
| 8. | 详细信息 |
|
已知镓(Ga)的原子序数为31,砷(As)的原子序数为33,有源相阵控雷达微波器材料常用到砷化镓和氨化镓。下列说法正确的是 A.氮化镓的化学式为Ga3N2 B.镓的原子半径比砷的大 C.在周期表中镓处于金属与非金属分界线处 D.砷的最高价氧化物对应的水化物是一种强酸
|
|
| 9. | 详细信息 | ||||||||||
|
我国不同能源发电量占比如下。下列说法错误的是
A.燃煤发电能量转换过程为化学能→电能→热能→机械能 B.水能、风能核能及太阳能都属于清洁能源 C.大幅度增大水电、核电、风电及太阳能发电比例,有利于环境保护 D.水能煤、风能及太阳能发电过程中均没有新核素生成
|
|||||||||||
| 10. | 详细信息 |
|
下图中①~⑦是短周期中同主族或同周期的元素,其主要化合价变化如图所示。则这七种元素位于
A.第IVA族 B.第VIIA族 C.第二周期 D.第三周期
|
|
| 11. | 详细信息 |
|
“绿水青山就是金山银山。”下列做法不符合这一发展理念的是 A.大力修复被重金属污染的士壤和水源 B.研发可降解塑料代替聚乙烯、聚苯乙烯等塑料 C.大量进口洋垃圾,回收其中的塑料和金属资源 D.合理使用农药、化肥,将生活污水和工业发水处理达标后排放
|
|
| 12. | 详细信息 |
|
设NA为阿伏加德罗常数的数值。下列说法正确的是 A.1mol乙烷中含有的共价键数日为6NA B.14g乙烯中含有的C-H键数目为2NA C.0.1molFe与0.1molCl2充分反应,转移的电子数月为0.3NA D.0.1molCH4与0.1molCl2经光照充分反应,生成CH3Cl的分子数为0.1NA
|
|
| 13. | 详细信息 |
|
海底锰结核中含有大量的锰,已知锰是一种难熔金属,活动性介于Al和Zn之间,实验室冶炼锰可采用的方法是 A.直接热分解MnO2 B.用Fe从MnCl2溶液中置换 C.用Al还原MnO2 D.用Na从MnSO4溶液中置换
|
|
| 14. | 详细信息 | ||||||||||||||||||||
|
在相同的四个容器中,取相同物质的量的碳(C)进行反应:C(s)+2NO(g)
|
|||||||||||||||||||||
| 15. | 详细信息 |
|
新进人元素周期表中的第117号元素钿(Ts)可通过如下反应合成:
A. B.核反应方程式中的X为电子 C. D.钿元素在周期表中所处的族序数等于周期序数
|
|
| 16. | 详细信息 |
|
关于反应2Na2O2+2H2O==4NaOH+O2↑的说法错误的是 A.H2O和O2都是共价化合物 B.Na2O2和NaOH都是离子化合物 C.Na2O2和O2均含非极性键 D.H2O和NaOH均含极性键
|
|
| 17. | 详细信息 |
|
向恒温恒容的密闭容器中充入H2(g)和I2(g)各0.1mol,发生反应:H2(g)+I2(g)
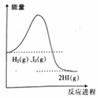
A该反应是吸热反应 B.断裂0.05molH-H键和0.05molI-I键消耗的总能量小于生成0.1molH-I键释放的总能量 C.当容器中气体密度不变时,说明反应已达到平衡状态 D.达到平衡时,生成HI的分子数约为0.2×6.02×1023
|
|
| 18. | 详细信息 | |||||||||||||||
|
下列物质的性质与用途对应关系错误的是
|
||||||||||||||||
| 19. | 详细信息 |
|
下列图示装置和原理均正确且能达到相应实验目的的是
A.用装置①验证石蜡可分解 B.用装置②除去甲烷中混有的少量乙烯 C.用装登③制取乙酸乙酯 D.用装置④分馏石油
|
|
| 20. | 详细信息 |
|
下列反应中原子利用率没有达到100%的是 A制取乙醇:CH2=CH2+H2O B.制取环氧乙烷:2CH2=CH2+O2 C.制取氯乙烯:4CH2=CH2+O2+2Cl2 D.制取环已烷:
|
|
| 21. | 详细信息 |
|
碳酸亚乙烯酯可用作一种锂离子电池的新型有机成膜添加剂,一种合成方法如下:
下列说法错误的是 A.①→②和②→③都属于加成反应 B.①与乙醛互为同分异构体 C.④的分子式为C3H2O2 D.①能与酸性KMnO4溶液反应
|
|
| 22. | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增大。W原子是周期表所有原子中半径最小的,X与Y处于同一周期且相邻,Y的最外层电子数是次外层的3倍,Z与W同主族。下列说法正确的是 A.原子半径:X<Y<Z B.单质的还原性:W>Z C.Y与Z的简单离子的电子层结构相同 D.W、X、Y三种元素只能组成共价化合物
|
|
| 23. | 详细信息 |
|
.镁-空气电池可用于海滩救生设备和高空雷达仪等。该电池两个电极分别是金属镁和不锈钢丝,其原理如图所示。下列说法正确的是
A.a极材料为镁 B.催化剂可以加快电子的转移 C.电流方向:b极→a极 D.每消耗1molMg,导线中共流过NA电子
|
|
| 24. | 详细信息 |
|
丁烷可发生如下反应:①C4H10 A.0.077 B.0.5 C.2 D.13
|
|
| 25. | 详细信息 |
|
.下列有关糖类油脂及蛋白质的说法正确的是 A.相同质量的这三种物质在人体内被完全氧化时,糖类释放的能量最多 B.油脂中的碳链均为碳碳单键时,主要是低沸点的植物油 C.蛋白质仅由碳、氢,氧三种元素组成 D.淀粉、纤维素及蛋白质均能发生水解
|
|
| 26. | 详细信息 |
|
(11)短周期主族元素W、X、Y、Z、M、R在周期表中的相对位置如图所示,X的最低负价的绝对值与M的最高正价数值相等。
回答下列问题: (1)X位于周期表中第___周期_____族;M的原子结构示意图为______。 (2)六种元素中原子半径最大的是_______(填元素符号)。 (3)W、X、Y、R四种元素的最简单氢化物中最稳定的是_____(填分子式)。 (4)X2Y2分子中各原子的最外层均达到8电子结构,则X2Y2的电子式为_______。 (5)M的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物发生反应的离子方程式为_____________。 (6)由Z与W两种元索形成的一种化合物U,当U与水反应时可生成Z的最高价氧化物对应的水化物和W的一种气态氢化物V。0.1molV在足量氧气中完全燃烧需消耗标准状况下8.96LO2,同时生成3.6g水。U的化学式为_________。
|
|
| 27. | 详细信息 |
|
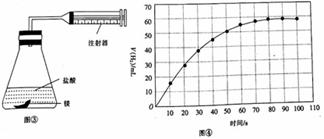
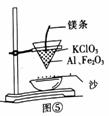
某校合作学习小组的同学设计实验探究镁、铁等金属的性质及应用。回答下列问题: (1)甲组同学用图①所示装置,分别将相同形状镁片、铁片和锌片放入相同温度、相同浓度和相同体积的盐酸中反应,测得产生H2的体积如图②所示,其中表示铁片的是_____(填字母);三种金属与盐酸反应的速率不同的原因是______________。
(2)乙组同学用图③所示装置进行镁与盐酸的反应,测得反应时间与收集的气体休积如图④所示:0~10 s.10~20 s.20~30s时间段收集到的H2体积不断减小的原因是________。
(3)丙组同学设计了图⑤所示装置进行实验,下列说法错误的是____________(填字母)。 a.Mg燃烧产生高温引发Al还原Fe2O3 b.从纸漏斗下端滴落的是熔化的铝和液态铁 C.该方法可用于冶炼V、Cr等难熔金属 (4)丁组同学用高纯度铁粉、炭粉、蛭石、NaCl固体及无纺布袋等制作“暧宝贴”。暖宝贴产生的热量来源是铁氧化放热。蛭石可以保温,其中炭粉的作用是____;NaCl的作用是____。
|
|
| 28. | 详细信息 |
|
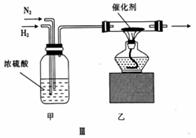
氨是世界上产量最多的无机化合物之一,既可用于生产氮肥,又可用作制冷剂、化工原料等。回答下列问题: (1)合成氨反应进程中的能量变化如图I所示,合成氨反应的速率与时间的关系如图II所示。
①合成氨反应为______(填“放热”或“吸热”)反应。 ②图II中虚线表示的反应是________(写化学方程式,不必注明条件);t1时刻,V(正)____(填“> “<”或“=”)v(逆)。 (2)某同学设计将N2与H2以体积比1:3通入图III所示装置制备氨气。
①装置甲中浓硫酸的作用是___________。 ②装置乙中反应出口气体成分有__________(填化学式)。 (3)图IV是氨燃料电池。A极为_____(填“正”或“负”)极;正极的电极反应式为______。
|
|
| 29. | 详细信息 |
|
煤炭资源必须实现“集约开发、绿色开采高效转化、清洁利用”。回答下列问题: (1)煤是一种______(填“可再生”或不可再生”)能源;煤干馏可得到焦炉气、煤焦油、粗氨水和________;萘( (2)我国目前工业锅护大多采用沸腾然烧锅炉,该如将固体燃料破碎成一定粒度的粉末。再被空气吹入炉内,在炉内以类似沸腾的状态燃烧(原理如图所示)。该燃烧技术的优点在于_________(填字母)。
a.减少炉中杂质气体(如SO2等)的形成 b.将煤炭转换为清洁能源,提高煤炭的热效率 c.使燃料燃烧充分,从而提高燃料的利用率 (3)化学链燃烧是由德国科学家Richter和Knoche于1983年提出的,该反应装置是由燃料反应器和空气反应器组成的。用Fe2O3代替氧气与合成气反应,可提高燃烧效率。实现化学链燃烧的转化示意图如下:
①该技术对能源进行了更为合理和高效的利用,且几平不产生氮氧化物;另一突出优点是____。 ②合成气中的气体有O2、CO2、H2O、________(写化学式) ③“空气反应器”中发生反应的化学方程式为_______________________。
|
|
| 30. | 详细信息 |
|
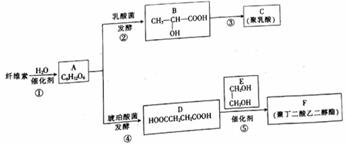
以纤维素为原料可合成可降解高分子C和F。回答下列问题:
(1)A的化学名称是_________。 (2)B中所含官能团的名称是__________。 (3)C的结构简式为________, 该反应的反应类型为__________。 (4)反应⑤的化学方程式为___________。
|
|









 ))
))