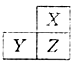2017高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列说法正确的是( ) A. 生成物的总能量大于反应物的总能量时,△H<0 B. 在其他条件不变的情况下,使用催化剂可以改变反应方向 C. △H<0、△S>0的反应在低温时不能自发进行 D. 一个化学反应的△H只与反应体系的始态和终态有关,而与反应的途径无关
|
|
| 2. | 详细信息 |
|
下列关于金属冶炼的叙述正确的是( ) A. 工业上可利用铝热反应大量冶炼金属铁 B. 金属钠、铝和铜都可用热还原法制备 C. CO还原磁铁矿得到9 mol铁时转移24 mol电子 D. 电解饱和氯化镁溶液可得金属镁
|
|
| 3. | 详细信息 |
|
工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费.有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( ) A. 通入氢气的电极为原电池的正极 B. 两极材料都用石墨,用稀盐酸做电解质溶液 C. 电解质溶液中的阳离子向通氯气的电极移动 D. 通氯气的电极反应式为Cl2+2e﹣═2Cl﹣
|
|
| 4. | 详细信息 |
|
下列关于有机物的说法中,正确的一组是 ①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物 ②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O ③石油的分馏、煤的气化和液化都是物理变化. ④淀粉和纤维素水解的最终产物都是葡萄糖 ⑤将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag ⑥除去CH4中的少量C2H4,可将混合气体通过盛有溴水的洗气瓶( ) A. ③⑤⑥ B. ④⑤⑥ C. ①②⑤ D. ②④⑥
|
|
| 5. | 详细信息 |
|
在密闭的容器中的一定量混合气体发生反应,xA(g)+yB(g) A. x+y<z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数下降
|
|
| 6. | 详细信息 |
|
下列说法错误的是( ) ①加热HgO制取Hg ②将钠加入氯化铜溶液中制取铜 ③电解熔融氯化铝制取铝 ④电解饱和食盐水来制取金属钠 ⑤不能利用铝热反应制取镁 A. ②④ B. ①③⑤ C. ②③④ D. ①⑤
|
|
| 7. | 详细信息 |
|
设NA为阿伏伽德罗常数,下列叙述不正确的是( ) A. 一定条件下,180g淀粉水解得到葡萄糖的分子数为NA B. 1 mol C10H22分子中共价键总数为31 NA C. 室温下,4.4 g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2 NA D. 88.0g干冰中含有的共用电子对对数为8NA
|
|
| 8. | 详细信息 |
|
常温下,反应2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行.下列说法正确的是( ) A. 该反应为吸热反应 B. 该反应中,SO2为还原剂 C. 1 mol H2S中含有的共价键的数目为3 mol D. 常温下,H2S的还原性强于S的还原性
|
|
| 9. | 详细信息 |
|
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
A. 原子半径:Y>Z>X B. 气态氢化物的热稳定性:X<Z C. y和z的最高价氧化物对应水化物均为强酸 D. 若z的最高正价为+m,则X的最高正价也一定为+m
|
|
| 10. | 详细信息 |
|
某元素二价阳离子核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( ) A. 18 B. 20 C. 16 D. 22
|
|
| 11. | 详细信息 |
|
下列除去杂质的方法正确的是( ) ①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 ②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 ③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 ④除去乙醇中少量的乙酸:加足量生石灰,蒸馏. A. ①② B. ②④ C. ③④ D. ②③
|
|
| 12. | 详细信息 |
|
一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CH3COONa固体;⑥NH4Cl固体;⑦CuSO4固体 ⑧CaCO3固体( ) A. ①②⑤⑦ B. ②③⑥ C. ②③④⑤ D. ②④⑤
|
|
| 13. | 详细信息 |
|
X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2,则X、Y可能是( ) ①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2.
A. ①②③④⑤ B. ②④⑤ C. ①③④ D. ①②③
|
|
| 14. | 详细信息 |
|
某可逆反应平衡常数表达式为K= A. 反应的热化学方程式为NO2(g)+SO2(g) B. 一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 C. 混合气体的平均摩尔质量保持不变,说明反应已达平衡 D. 使用合适的催化剂可使该反应的反应速率和平衡常数增大
|
|
| 15. | 详细信息 |
|
下列说法中正确的说法有几个( ) ①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率 A. 1个 B. 2个 C. 3个 D. 4个
|
|
| 16. | 详细信息 |
|
在一个密闭容器中进行如下反应:2X2(g)+Y2(g) A. Z的浓度为0.4 mol·L-1 B. X2、Z的浓度均为0.15 mol·L-1 C. X2的浓度为0.4 mol·L-1 D. X2与Z的浓度之和为0.4 mol·L-1
|
|
| 17. | 详细信息 | |||||||||
|
把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
则反应NH3·H2O (l) A. +2.1 B. +4.2 C. +52.7 D. 缺少数据无法计算
|
||||||||||
| 18. | 详细信息 |
|
下列两组热化学方程式中,有关△H的比较正确的是( ) ①CH4(g)+O2(g)=CO2(g)+2H2O(g) △H1 CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H2 ②NaOH(aq)+ NaOH (aq)+CH3 COOH( aq)=CH3COONa( aq)+H2O(1) △H4 A. △Hl>△H2,△H3>△H4 B. △HI>△H2,△H3<△H4 C. △H1=△H2,△H3 =△H4 D. △Hl<△H2,△H3<△H4
|
|
| 19. | 详细信息 | ||||||||||||||||||||||||||||||
|
有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C﹣H、C﹣C、C=C、C﹣O、C=O、O﹣H.下列各反应中,反应物分子中断裂键的排列,正确的组合是( )
A. ① B. ② C. ③ D. ④
|
|||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则有机物可能是( ) A. CH3CH2OH B. HOOC﹣COOH C.
|
|
| 21. | 详细信息 |
|
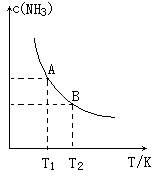
Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0 (填“>”或“<”) 。 (2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________。 (3)T1温度下该反应的化学平衡常数K1=___________。 (4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=)。 Ⅱ.根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。 (1)此反应的△S_______0(填“>”或“<”)。 已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1 2NO(g)+O2(g)=2NO2(g) △H =-b kJ·mol-1; CO的燃烧热△H =-c kJ·mol-1。 (2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式________。
|
|
| 22. | 详细信息 | |||||||||||||||||
|
海水中不仅含有丰富的非金属元素资源(如Cl、Br、I等),还含有丰富的金属元素资源(如Na、Mg、Fe、Cr等)。 (1)海水晒盐的原理是________;写出氯化钠的电子式:________________;与Na、Cl同周期,且简单离子半径最小的离子结构示意图:______________; (2)晒出的粗盐常混有MgSO4、CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,②________,③加过量Na2CO3溶液,④________,⑤过滤除去杂质,⑥________,⑦蒸发结晶; (3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+、Cr3+等,为富集镁使其转化为MgCl2晶体。 有关资料:
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是: ①先加________;目的是_______________________________; ②再加________;目的是_______________________________。
|
||||||||||||||||||
| 23. | 详细信息 |
|
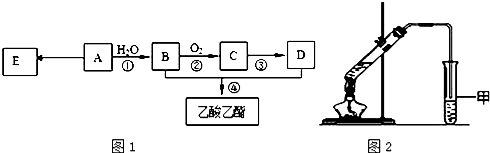
为测定某烃A的分子组成和结构,对这种烃进行以下实验: ①取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。 ②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。 现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
(1)A分子中官能团的名称是___________,0.1mol该烃A能与_______g溴发生加成反应;加成产物需_______mol溴蒸气完全取代。B中官能团的名称是________________; (2)写出C的结构简式_______________; (3)反应②的化学方程式是______________________________; 反应④的化学方程式是______________________________; (4)E是常见的高分子材料,合成E的化学方程式是__________________________。 (5)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体. ①实验开始时,试管甲中的导管不伸入液面下的原因是_______________; ②上述实验中饱和碳酸钠溶液的作用是(填字母)_____________; A.中和乙酸和乙醇 B.中和乙酸并吸收部分乙醇 C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出 D.加速酯的生成,提高其产率 ③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,不能生成1mol 乙酸乙酯,原因是_____________________________________________。
|
|
| 24. | 详细信息 |
|
五种短周期元素A、B、C、D、E、F的原子序数依次增大.A和C同族,B和E同族,C离子和B离子具有相同的电子层结构,D的最外层电子数与电子层数相同.A和B、E、F均能形成共价化合物(由分子构成的化合物).A和B形成的化合物在水中呈碱性,C和F形成的化合物在水中呈中性. 回答下列问题: (1)五种元素中,原子半径最大的是______.(填元素名称)最高价氧化物对应水化物酸性最强的元素为____ (填元素符号),其最高价氧化物对应水化物与NaOH反应的离子方程式为___________________________. (2)由A和B、E、F所形成的化合物中,热稳定性最差的是______ (用化学式表示). (3)A和F形成的化合物与A和B形成的化合物反应,产物的化学式为________。 (4)D元素最高价氧化物的化学式为_______,最高价氧化物对应水化物与氢氧化钠反应的离子方程式为___________________________. (5)单质F与水反应的离子方程式为___________________.
|
|