2017广东高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
有机物① CHOH(CHOH)4CHO ② CH3CH2CH2OH ③ CH2=CH-CH2OH ④CH2=CH-COOCH3 ⑤ CH2=CH-COOH中,既能发生加成、酯化反应,又能发生氧化反应的是( ) A.③⑤ B.①③⑤ C.②④ D.①③
|
|
| 2. | 详细信息 |
|
下列有机分子中,所有的原子不可能处于同一平面的是( ) A. C.
|
|
| 3. | 详细信息 |
|
只用水就能鉴别的一组物质是 ( ) A. 苯、乙酸、四氯化碳 B.乙醇、乙醛、乙酸 C. 乙醛、乙二醇、硝基苯 D.苯酚、乙醇、甘油
|
|
| 4. | 详细信息 |
|
化合物 A.3 B.5 C.6 D.9
|
|
| 5. | 详细信息 |
|
右图有机物X是一种医药中间体,下列有关这个化合物的说法正确的是( ) A.化合物X的分子式是C16H11O4 B.不能与饱和Na2CO3溶液反应 C.化合物X可由 D.1 mol化合物X最多能与3 mol NaOH反应
|
|
| 6. | 详细信息 |
|
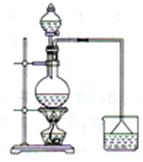
下列实验方案能达到实验目的的是( ) A.用苯和饱和溴水制溴苯 B.用右图所示装置制备乙酸乙酯 C.常温下苯酚的溶解度很小,可以过滤分离水中未完全溶解的苯酚 D.在溴乙烷水解混合体系中滴加硝酸银溶液检验溴离子的存在
|
|
| 7. | 详细信息 |
|
下列关于有机化合物的说法正确的是( ) A.乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 B.2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目相同 C.淀粉和纤维素是同分异构体 D.油脂的皂化反应属于加成反应
|
|
| 8. | 详细信息 |
|
在容积不变的密闭容器中,发生反应CO(g)+ 2H2(g) A.H2的消耗速率等于CH3OH的生成速率的2倍 B.CO和H2的转化率相等 C.容器内的压强不再改变 D.体系中气体的密度不再改变
|
|
| 9. | 详细信息 |
|
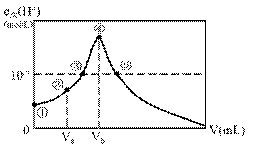
常温下,将HCl气体通入到20 mL 0.1000 mol•L-1 NH3•H2O(Kb=1.7×10-5)溶液中,溶液中由水电离出的c(H+)与通入的HCl气体的体积V之间关系如右图所示,假设整个过程中溶液体积保持不变。下列说法错误的是( ) A.点③溶液呈中性 B.点④溶液中c(Cl-)=c(NH3•H2O)+ c(NH4+) C.点③时水的电离程度比点⑤小 D.2Va=Vb,点②时溶液中c(NH4+)>c(Cl-)>c(NH3•H2O)
|
|
| 10. | 详细信息 |
|
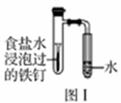
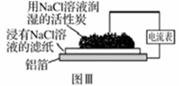
在日常生话中,我们经常看到铁制品生锈,铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )
A.图Ⅰ装置实验,一段时间后可以观察到导管内液柱下降 B.图Ⅰ的负极材料是铁钉,电极方程式是Fe-3e-=Fe3+ C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ D.图Ⅲ装置的总反应为4Al+ 3O2+ 6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
|
|
| 11. | 详细信息 | ||||||||||||||||||
|
汽车尾气脱硝脱碳主要原理为:2NO(g)+ 2CO(g)
A.一定温度下,从开始到平衡,该反应的平衡常数逐渐增大 B.前2s内的平均反应速率v(N2)= 1.75×10-3 mol•L-1•s-1 C.达到平衡时,CO的转化率为11. 11% D.3s时NO和CO的浓度都不再变化,反应停止进行
|
|||||||||||||||||||
| 12. | 详细信息 |
|
用已知浓度的KMnO4标准溶液滴定未知浓度的H2C2O4溶液,下列说法正确的是( )
B.装KMnO4标准溶液的滴定管应如右图排气泡 C.滴定前锥形瓶中有少量蒸馏水会影响滴定结果 D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失会导致H2C2O4溶液测定结果偏大
|
|
| 13. | 详细信息 |
|
下列哪一种微粒的中心原子属于sp3杂化( ) A.BCl3 B.CO2 C.PCl3 D.HCHO
|
|
| 14. | 详细信息 |
|
下列哪一种是sp2 杂化轨道的电子云轮廓图( ) A.
|
|
| 15. | 详细信息 |
|
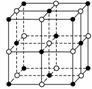
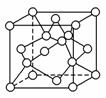
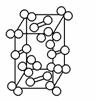
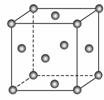
几种晶体的晶胞如图所示:所示晶胞从左到右分别表示的物质是( )
A.碘、铜、氯化钠、金刚石 B.氯化钠、金刚石、碘、铜 C.氯化钠、铜、碘、金刚石 D.铜、氯化钠、碘、金刚石
|
|
| 16. | 详细信息 |
|
下列物质,按沸点降低顺序排列的一组是( ) A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2 C.H2O、H2S、H2Se、H2Te D.CI4、CBr4、CCl4、CF4
|
|
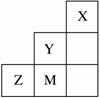
| 17. | 详细信息 |
|
右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( ) A.ZM2分子中各原子的最外层均满足8电子稳定结构 B.离子半径:M->Z2->Y- C.电负性:Y>Z>M D.Z元素基态原子最外层电子排布图为:
|
|
| 18. | 详细信息 |
|
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料。结合联氨的结构判断下列说法正确的是( ) A.联氨的晶体是原子晶体 B.联氨易溶于水 C.1 mol联氨分子中含有5NA个σ键和NA个π键 D.联氨分子是非极性分子
|
|
| 19. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
下表是元素周期表的一部分,所列字母分别代表某一种化学元素,下列说法正确的是( )
A.第一电离能:B>C>D B.Z(BD)5分子是极性分子 C.C形成的常见单质中σ键与π键个数之比为1∶2 D.B、C、D形成的气态氢化物互为等电子体
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
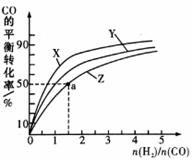
前段时间,特朗普宣布美国退出巴黎气候协议,这使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。 (1) 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g)=CH3OH(g) △H1=-116 kJ/mol ① 下列措施中,一定有利于增大该反应的反应速率的是( ) A.随时将CH3OH与反应混合物分离 B.降低反应温度 C.增大体系压强 D.使用高效催化剂 ② 已知:CO(g)+ H2(g)+
③ 在容积为2 L的恒容容器中,分别研究在230℃、250℃和270℃ 三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。请回答: i)在上述三种温度中,曲线Z对应的温度是 ; ii)利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+ 2H2(g)= CH3OH(g)的平衡常数K= 。 (2) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 Ksp=2.8×10-9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。 (3) 甲醇燃料电池是一种绿色环保的新型电源,写出在酸性介质中该电池的负极方程式 。
|
|
| 21. | 详细信息 |
|
C、N、O、Cl是重要的非金属元素,它们的单质和化合物有重要应用。请问: (1) C、N、O、Cl四种元素中基态原子未成对电子数最多的是__________,C、O、Cl原子得到电子时放出热量,而N原子得到电子却吸收热量的原因是_________。 (2) NO3-的空间构型为_________;H2O分子中∠HOH键角小于NH3分子中∠HNH键角的原因是_____________。 (3) CO可形成多种配位化合物,CO的结构式为_______,与CO互为等电子体且带1个单位负电荷的阴离子化学式为 。 (4) 下图是几种碳的同素异形体,它们的碳原子都是 杂化;富勒烯C60的晶胞属于面心立方堆积,则每个C60晶胞中有 个碳原子。
(5) 已知:NaCl晶体的密度为a g●cm-3,则NaCl晶体中最近两个Na+的距离的数学表达式为______cm(用含a、NA的式子表示)。
|
|
| 22. | 详细信息 |
|
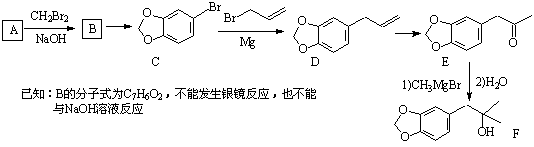
化合物A(分子式为:C6H6O2)是一种有机化工原料,在空气中易被氧化。由A 合成黄樟油(E)和香料F的合成路线如下(部分反应条件已略去):
(1)写出C的官能团名称: 和 。 (2)写出反应C→D的反应类型: 。 (3)写出反应A→B的化学方程式: (4)某芳香化合物是F的同分异构体,符合以下条件的有 种: ①苯环上有两个对位取代基;②有醇羟基 ③既可以发生银镜反应又可以发生水解反应; 写出以上同分异构体中不能发生消去反应的的结构简式: (任写一种)。 (5)根据已有知识并结合流程中相关信息,写出以 |
|

 D
D