2018高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O2、太空中的甲醇气团等。下列说法中正确的是( ) A.18O16O是由极性键形成的极性分子 B.甲醇(CH3OH)属于离子化合物 C.N5和N2是氮元素的两种同位素 D.由N5变成N2是化学变化
|
|
| 2. | 详细信息 |
|
下列有关化学用语表示正确的是( ) A.NaClO的电子式:Na∶ C.氯离子的结构示意图:
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.蛋白质溶液、淀粉溶液都属于胶体 B.碳纤维、纤维素都是有机高分子 C.花生油,牛油互为同分异构体 D.普通玻璃、石英玻璃、水玻璃都是硅酸盐
|
|
| 4. | 详细信息 |
|
下列说法正确的是( ) A.气象环境报告中新增的“PM2.5”是一种新的分子 B.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 C.小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多 D.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
|
|
| 5. | 详细信息 |
|
下列事实不能用元素周期律解释的是( ) A.气态氢化物的稳定性:HBr>HI B.0.1 mol·L-1溶液的pH:NaOH>LiOH C.向Na2SO3溶液中加盐酸,有气泡产生 D.Mg、Al与同浓度盐酸反应,Mg更剧
|
|
| 6. | 详细信息 |
|
随着科学技术的不断进步,研究物质的手段和途径越来越多, N A.N C.C60和12C、14C互为同位素 D.H2与H3属于同素异形体
|
|
| 7. | 详细信息 |
|
下列物质的转化在给定条件下能实现的是( ) A.H2SO4(稀) B.饱和NaCl(aq) C.Fe D.Al
|
|
| 8. | 详细信息 |
|
设NA为阿伏加德罗常数值。下列有关叙述正确的是( ) A.14 g乙烯和丙烯混合气体中的氢原子数为2NA B.1 molN2与4 mol H2反应生成的NH3分子数为2NA C.1 molFe溶于过量硝酸,电子转移数为2NA D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
|
|
| 9. | 详细信息 |
|
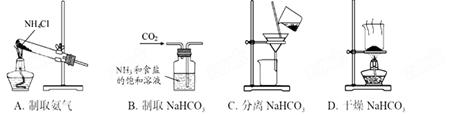
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
|
|
| 10. | 详细信息 |
|
某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为( ) A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3 、BaCO3 D.Na2CO3、CuSO4
|
|
| 11. | 详细信息 | |||||||||||||||
|
化学在生活中有着广泛的应用,下列对应关系错误的是( )
|
||||||||||||||||
| 12. | 详细信息 |
|
.下列说法正确的是( ) A.P的非金属性强于Si,H3PO4比H2SiO3的酸性强 B.I的原子半径大于Br,HI比HBr的热稳定性强 C.Al2O3和MgO均可与NaOH溶液反应 D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
|
|
| 13. | 详细信息 |
|
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( ) A.氯水的颜色呈浅绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
|
|
| 14. | 详细信息 |
|
将22.4 g铁粉逐渐加入含HNO3 0.8 mol的硝酸溶液中,反应生成的气体的物质的量(x)(假设HNO3的还原产物只有NO)随消耗铁粉的物质的量(y)变化关系中正确的是( )
|
|
| 15. | 详细信息 |
|
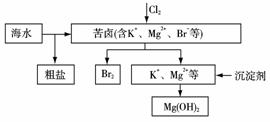
海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
|
|
| 16. | 详细信息 |
|
短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素。下列说法不正确的是( ) A.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2 B.Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y C.W的简单氢化物稳定性比Z的简单氢化物稳定性低 D.Y与W形成的化合物YW2的熔点高、硬度大
|
|
| 17. | 详细信息 |
|
下列关于离子共存或离子反应的说法正确的是( ) A.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+===2Fe3++2H2O B.pH=2的溶液中可能大量存在Na+、NH C.某无色溶液中可能大量存在H+、Cl-、MnO D.稀硫酸与Ba(OH)2溶液的反应:H++SO
|
|
| 18. | 详细信息 |
|
实验室常用98%(ρ=1.84 g·mL-1)的浓H2SO4配制1∶4 的稀H2SO4,此稀H2SO4的密度为1.23 g·mL-1,其物质的量浓度为( ) A.4.6 mol·L-1 B.5.7 mol·L-1 C.3.88 mol·L-1 D.18.4 mol·L-1
|
|
| 19. | 详细信息 |
|
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( ) A.氧气是氧化产物 B.O2F2既是氧化剂又是还原剂 C.若生成4.48 L HF,则转移0.8 mol电子 D.还原剂与氧化剂的物质的量之比为1:4
|
|
| 20. | 详细信息 |
|
无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图各装置,结果得到酸性溶液,而几乎无气体剩余,下列说法不正确的是( )
A.气体甲中不可能有NO2和N2 B.气体甲中有20 mL NH3 C.通过足量Na2O2后剩余的气体只有NO2 D.气体乙中有32 mL NO和48 mL CO2
|
|
| 21. | 详细信息 |
|
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( ) A.60 mL B.45 mL C.30 mL D.15 mL
|
|
| 22. | 详细信息 | |||||||||||||||||||||||||
|
下列除杂方案错误的是( )
|
||||||||||||||||||||||||||
| 23. | 详细信息 |
|
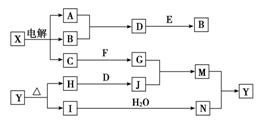
系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I均为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题: (1)B中所含元素位于周期表中第________周期,________族。 (2)A在B中燃烧的现象是_____________________________。 (3)D+E→B的反应中,被氧化与被还原的物质的物质的量之比是________。 (4)G+J→M的离子方程式是__________________________。
|
|
| 24. | 详细信息 |
|
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题: (1)元素X的最高价氧化物的电子式为________;元素Z的离子结构示意图为________。 (2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为_______________________________________________________。 (3)元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________________________________________。 (4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:__________________________________。 (5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________________________________。
|
|
| 25. | 详细信息 |
|
Ⅰ.煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为: ①2FeS2+7O2+2H2O ②Fe2++O2+H+ ③FeS2+2Fe3+ ④2S+3O2+2H2O 已知:FeS2中的硫元素为-1价。 回答下列问题: (1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。 (2)反应③的还原剂是__________________。 (3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来。 Ⅱ.在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是____________________________。在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________。(提示:碘元素被氧化成IO Ⅲ.工业上用黄铜矿( CuFeS2)冶炼铜,副产品中有SO2 ,冶炼铜的反应为8CuFeS2+21O2
|
|
| 26. | 详细信息 |
|
铜是重要的工业原料,现有Cu、Cu2O组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g该混合物加入0.5 L 3.4 mol·L-1的稀硝酸中,固体物质完全反应,生成4. 48 L(标准状况)的NO。向所得溶液中加入a L 2.0 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+沉淀完全。 (1)Cu2O与稀硝酸反应的化学方程式为____________________________________。 (2)混合物中,n(Cu)=________;n(Cu2O)=________。 (3)a=________。
|
|
| 27. | 详细信息 |
|
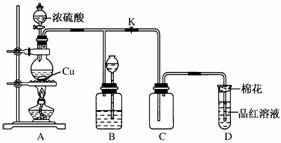
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。 请回答:
(1)装置A中发生反应的化学方程式为____________________________________。 (2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是________,其作用是________________________________。 (3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________________________________。B中应放置的液体是________(填字母)。 a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液 (4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。 ①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________________________________________________________________。 ②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是________(填字母)。 a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
|
|
 D
D