2016жІіеҚ—й«ҳдёүдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
NAд»ЈиЎЁйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺе°Ҷи¶ійҮҸзҡ„й“ңзүҮдёҺеҗ«жңү0.4molHNO3зҡ„жө“зЎқй…ёе……еҲҶеҸҚеә”з”ҹжҲҗNO2 зҡ„еҲҶеӯҗж•°дёә0.2 NA BпјҺO2 е’ҢN2зҡ„ж··еҗҲж°”22.4LдёӯдёҖе®ҡеҗ«жңү2 NAдёӘеҺҹеӯҗ CпјҺжҹҗйҶӢй…ёй’ жә¶ж¶Ідёӯеҗ«жңү1molCH3COOвҖ”зҰ»еӯҗпјҢеҲҷNa+ж•°зӣ®зӯүдәҺNA DпјҺ14 gй“ҫзғғпјҲеҲҶеӯҗйҖҡејҸдёәCnH2n пјҢnвүҘ2пјүдёӯеҗ«жңүзҡ„C=Cй”®ж•°зӣ®дёҖе®ҡдёәNA/n
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеӯҰз”ҹзҡ„е®һйӘҢжҠҘе‘ҠжүҖеҲ—еҮәзҡ„дёӢеҲ—ж•°жҚ®дёӯеҗҲзҗҶзҡ„жҳҜ AпјҺз”Ё10mLйҮҸзӯ’йҮҸеҸ–7.13mLзЁҖзӣҗй…ёВ В В В В BпјҺз”ЁpHи®ЎжөӢеҫ—жҹҗзЁҖзӣҗй…ёзҡ„pHдёә1.54 CпјҺз”ЁзўұејҸж»ҙе®ҡз®ЎйҮҸеҸ–20.3 mLзғ§зўұжә¶ж¶ІВ DпјҺз”ЁжүҳзӣҳеӨ©е№із§°еҫ—жҹҗзү©иҙЁзҡ„иҙЁйҮҸдёә13.15g
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ0.25 mol Na2OдёӯпјҢеҗ«жңүзҡ„ж°§зҰ»еӯҗж•°зәҰдёә AгҖҒ1дёӘВ В В В В В BгҖҒ0.25дёӘВ В В В В CгҖҒ1.5Г—1023дёӘВ В В В В DгҖҒ6.02Г—1023дёӘ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҘдёӢжқҗж–ҷдёӯпјҢеұһдәҺзЎ…й…ёзӣҗжқҗж–ҷзҡ„жҳҜпјҲВ В В В пјү AпјҺй“қеҗҲйҮ‘В В В В В В BпјҺзўізәӨз»ҙВ В В В В В CпјҺжҷ®йҖҡзҺ»з’ғВ В В В В В DпјҺеЎ‘ж–ҷ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
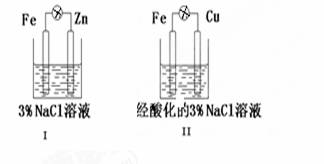
з»“еҗҲеӣҫеҲӨж–ӯпјҢ
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ AпјҺв… е’Ңв…ЎдёӯжӯЈжһҒеқҮиў«дҝқжҠӨ BпјҺв… е’Ңв…ЎдёӯCl- еқҮеҗ‘Feз”өжһҒ移еҠЁ CпјҺв… е’Ңв…ЎдёӯиҙҹжһҒеҸҚеә”еқҮжҳҜFe-2e-=Fe2+ DпјҺв… е’Ңв…ЎдёӯжӯЈжһҒеҸҚеә”еқҮжҳҜO2+4e-+2H2O=4OH-
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
жҢүеҸіеӣҫиЈ…зҪ®е®һйӘҢпјҢAгҖҒBдёӨзғ§жқҜеҲҶеҲ«зӣӣж”ҫ200g10пј…NaOHе’Ңи¶ійҮҸCuSO4жә¶ж¶ІгҖӮйҖҡз”өдёҖ ж®өж—¶й—ҙеҗҺпјҢcжһҒдёҠжңүCuжһҗеҮәпјӣеҸҲжөӢеҫ—AжқҜдёӯжә¶ж¶Ізҡ„иҙЁйҮҸеҮҸе°‘4.5 g (дёҚиҖғиҷ‘ж°ҙзҡ„и’ёеҸ‘)гҖӮВ еҲҷдёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ пјҲВ В В пјү AпјҺз”өжәҗPжһҒдёәжӯЈжһҒ BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢbжһҒдә§з”ҹж°”дҪ“зҡ„дҪ“з§Ҝдёә5.6 L CпјҺcжһҒдёҠжһҗеҮәеӣәдҪ“зҡ„иҙЁйҮҸдёә16 g DпјҺaжһҒдёҠжүҖеҸ‘з”ҹзҡ„з”өжһҒеҸҚеә”ејҸдёә40HпјҚпјҚ4eпјҚ= 2H2O+O2вҶ‘
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҸҗзәҜзү©иҙЁзҡ„е®һйӘҢж–№жі•дёҚжӯЈзЎ®зҡ„жҳҜ В В В в‘ з”ЁNa2CO3жә¶ж¶ІйҷӨеҺ»ж··еңЁNaClжә¶ж¶Ідёӯзҡ„MgCl2жқӮиҙЁ В В В в‘Ўз”Ёи’ёйҰҸжі•йҷӨеҺ»ж··еңЁж°ҙдёӯзҡ„ж°§ж°” В В В в‘ўз”Ёй…’зІҫиҗғеҸ–жә¶и§ЈеңЁж°ҙдёӯзҡ„жәҙ В В В в‘Је°ҶKMnO4жә¶ж¶ІеҮҸеҺӢдҪҺжё©и’ёеҸ‘пјҢд»ҘиҺ·еҫ—жҷ¶дҪ“KMnO4 В В В AпјҺв‘ЎВ В В В В BпјҺв‘ўв‘ЈВ В В В В В В CпјҺв‘ в‘Ўв‘ўВ В В В В DпјҺв‘ в‘Ўв‘ўв‘Ј
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжё©еәҰдёӢпјҢе°Ҷ1 mol N2е’Ң3 mol H2ж”ҫе…ҘжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯпјҢиҫҫеҲ°е№іиЎЎж—¶пјҢжөӢеҫ—NH3дёә0.8 molпјҢеҰӮжһңжӯӨж—¶еҶҚеҠ е…Ҙ1 mol N2е’Ң3 mol H2пјҢиҫҫеҲ°ж–°е№іиЎЎж—¶пјҢNH3зҡ„зү©иҙЁзҡ„йҮҸ AпјҺзӯүдәҺ0.8 molВ В В В В В В В В В В В В В В В BпјҺзӯүдәҺ1.6 mol CпјҺеӨ§дәҺ0.8 molе°ҸдәҺ1.6 molВ В В В DпјҺеӨ§дәҺ1.6 mol
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҺӘж–ҪжҲ–дәӢе®һиғҪз”ЁеӢ’жІҷзү№еҲ—еҺҹзҗҶи§ЈйҮҠзҡ„жҳҜ(В В В В ) AпјҺеңЁеҗҲжҲҗж°ЁпјҲжӯЈеҸҚеә”жҳҜж”ҫзғӯпјүзҡ„еҸҚеә”дёӯпјҢеҚҮжё©жңүеҲ©дәҺж°Ёзҡ„еҗҲжҲҗ BпјҺH2гҖҒI2гҖҒHIдёүиҖ…зҡ„е№іиЎЎж··еҗҲж°”пјҢеҠ еҺӢ(зј©е°Ҹе®№еҷЁдҪ“з§Ҝ)еҗҺйўңиүІеҸҳж·ұ CпјҺй’ўй“ҒеңЁжҪ®ж№ҝзҡ„з©әж°”дёӯжӣҙе®№жҳ“з”ҹй”Ҳ DпјҺж°Ҝж°”еҸҜд»Ҙз”ЁжҺ’йҘұе’ҢйЈҹзӣҗж°ҙзҡ„方法收йӣҶ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
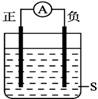
еҰӮеӣҫжүҖзӨәпјҢз”өжөҒи®Ўзҡ„жҢҮй’ҲеҸ‘з”ҹеҒҸиҪ¬пјҢжӯЈжһҒеҸҳзІ—пјҢиҙҹжһҒеҸҳз»ҶпјҢз¬ҰеҗҲиҝҷз§Қжғ…еҶөзҡ„жҳҜ
AпјҺжӯЈжһҒCuпјҢиҙҹжһҒZnпјҢSдёәзЁҖH2SO4 BпјҺжӯЈжһҒZnпјҢиҙҹжһҒCuпјҢSдёәCuSO4жә¶ж¶І CпјҺжӯЈжһҒAgпјҢиҙҹжһҒZnпјҢSдёәAgNO3жә¶ж¶І DпјҺжӯЈжһҒFeпјҢиҙҹжһҒCuпјҢSдёәAgNO3жә¶ж¶І
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ AпјҺж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„е®һиҙЁжҳҜзӣёдә’дәӨжҚўжҲҗеҲҶ BпјҺеңЁж°§еҢ–иҝҳеҺҹеҸҚеә”дёӯпјҢеҢ–еҗҲд»·еҸҳеҢ–зҡ„дёҖе®ҡжҳҜдёҚеҗҢе…ғзҙ CпјҺеңЁж°§еҢ–иҝҳеҺҹеҸҚеә”дёӯпјҢж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮдёҖе®ҡжҳҜдёҚеҗҢзү©иҙЁ DпјҺжҹҗе…ғзҙ з”ұжёёзҰ»жҖҒиҪ¬еҢ–дёәеҢ–еҗҲжҖҒпјҢиҝҷз§Қе…ғзҙ дёҚдёҖе®ҡиў«ж°§еҢ–дәҶ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°дёӯй”ҷиҜҜзҡ„жҳҜпјҲВ В В В пјү AпјҺеҺҹеӯҗеҚҠеҫ„пјҡCl>S>OВ В В В В В В В В В BпјҺиҝҳеҺҹжҖ§пјҡNa>Mg>Al CпјҺзЁіе®ҡжҖ§пјҡHF>HCl>HBrВ В В В В В В В DпјҺй…ёжҖ§пјҡHClO4>H2SO4>H3PO4
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪжӯЈзЎ®иЎЁзӨәдёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә AпјҺзЎ«еҢ–дәҡй“Ғжә¶дәҺзЁҖзЎқй…ёдёӯпјҡFeS+2HпјӢпјқFe2пјӢ+ H2SвҶ‘ BпјҺNH4HCO3жә¶дәҺиҝҮйҮҸзҡ„NaOHжә¶ж¶ІдёӯпјҡHCO3пјҚ+OHпјҚпјқCO32пјҚ+H2O CпјҺе°Ҷ1 mol/L NaAlO2жә¶ж¶Іе’Ң1.5 mol/L HClжә¶ж¶ІзӯүдҪ“з§Ҝдә’зӣёеқҮеҢҖж··еҗҲпјҡ 6AlO2пјҚ+9HпјӢ+3H2Oпјқ5Al(OH)3вҶ“+Al3пјӢ DпјҺNaClOжә¶ж¶ІдёҺFeCl2жә¶ж¶Іж··еҗҲпјҡFe2++2ClOпјҚ+2H2OпјқFe(OH)2вҶ“+2HClO
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
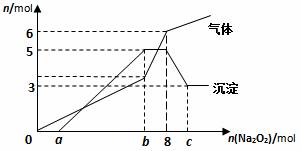
е°ҶNa2O2йҖҗжёҗеҠ е…ҘеҲ°еҗ«жңүH+гҖҒMg2+гҖҒAl3+гҖҒNH4+зҡ„ж··еҗҲж¶Ідёӯ并еҫ®зғӯпјҢдә§з”ҹжІүж·Җе’Ңж°”дҪ“зҡ„зү©иҙЁзҡ„йҮҸпјҲmolпјүдёҺеҠ е…Ҙзҡ„Na2O2зү©иҙЁзҡ„йҮҸпјҲmolпјүзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҢеҲҷеҺҹжә¶ж¶Ідёӯзҡ„Mg2+гҖҒAl3+гҖҒNH4+зү©иҙЁзҡ„йҮҸеҲҶеҲ«
AпјҺ 2 molгҖҒ3 molгҖҒ6 mol В В В В В BпјҺ 3 molгҖҒ2 molгҖҒ6mol CпјҺ 2 molгҖҒ3 molгҖҒ4 mol В В В В В DпјҺ 3 molгҖҒ2 molгҖҒ2 mol
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘKsp(AgCl)=1.56Г—10-10,Ksp(AgBr)=7.7Г—10-13,Ksp(Ag2CrO4)=9.0Г—10-12гҖӮжҹҗжә¶ж¶Ідёӯеҗ«жңүCl-гҖҒBr-е’ҢCr AпјҺCl-гҖҒBr-гҖҒCr
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||
|
зЎ…еҸҠе…¶еҢ–еҗҲзү©еҜ№дәәзұ»зҺ°д»Јж–ҮжҳҺе…·жңүзү№ж®ҠиҙЎзҢ®пјҢиҜ·еӣһзӯ”дёӢеҲ—жңүе…ій—®йўҳпјҡ (1)зЎ…еҺҹеӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ________гҖӮ (2)дёӢеҲ—зү©е“ҒжҲ–и®ҫеӨҮжүҖз”Ёзҡ„жқҗж–ҷеұһдәҺзЎ…й…ёзӣҗзҡ„жҳҜ________гҖӮ в‘ й•ҝжұҹдёүеіЎж°ҙжіҘеӨ§еққпјӣв‘ЎзҹіиӢұе…үеҜјзәӨз»ҙпјӣв‘ўйҷ¶з“·еқ©еҹҡпјӣв‘Јжҷ®йҖҡзҺ»з’ғпјӣв‘ӨзЎ…еӨӘйҳіиғҪз”өжұ AпјҺв‘ в‘Ўв‘ўВ В В В В В BпјҺв‘ўв‘Јв‘ӨВ В В В В В CпјҺв‘Ўв‘ўв‘ЈВ В В В В В DпјҺв‘ в‘ўв‘Ј (3)еёёжё©дёӢпјҢSiCl4дёәж¶ІжҖҒпјҢжІёзӮ№дёә57.6в„ғпјҢеңЁз©әж°”дёӯеҶ’зҷҪйӣҫгҖӮеҲ¶еӨҮй«ҳзәҜеәҰзЎ…зҡ„дёӯй—ҙдә§зү©SiCl4дёӯжә¶жңүж¶ІжҖҒжқӮиҙЁпјҢиӢҘиҰҒеҫ—еҲ°й«ҳзәҜеәҰSiCl4пјҢеә”йҮҮз”Ёзҡ„ж–№жі•жҳҜ________пјӣз”ЁеҢ–еӯҰж–№зЁӢејҸеҸҠеҝ…иҰҒж–Үеӯ—и§ЈйҮҠSiCl4еңЁз©әж°”дёӯеҶ’зҷҪйӣҫзҡ„еҺҹеӣ пјҡ_______________________________________гҖӮ (4)е·ҘдёҡдёҠеҸҜз”ЁSiCl4(g)еҲ¶еӨҮй«ҳжё©з»“жһ„йҷ¶з“·ж°®еҢ–зЎ…пјҢе…¶еҸҚеә”ж–№зЁӢејҸдёә 3SiCl4(g)пјӢ2N2(g)пјӢ6H2(g) й«ҳжё© = в‘ иҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°иЎЁиҫҫејҸKпјқ______________. в‘ЎеңЁеҜҶй—ӯжҒ’е®№е®№еҷЁдёӯпјҢиғҪиЎЁзӨәдёҠиҝ°еҸҚеә”иҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜ________гҖӮ AпјҺ3vйҖҶ(N2)пјқvжӯЈ(H2) BпјҺvжӯЈ(HClпјқ4vжӯЈпјқ4vжӯЈ(SiCl4) CпјҺж··еҗҲж°”дҪ“еҜҶеәҰдҝқжҢҒдёҚеҸҳ DпјҺc(N2)вҲ¶c(H2)вҲ¶c(HCl)пјқ1вҲ¶3вҲ¶6 в‘ўеңЁжҹҗжқЎд»¶дёӢиҫҫеҲ°е№іиЎЎж—¶пјҢH2дёҺHClзү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәmвҲ¶nпјӣдҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢйҷҚдҪҺжё©еәҰиҫҫеҲ°е№іиЎЎж—¶пјҢH2дёҺHClзү©иҙЁзҡ„йҮҸд№ӢжҜ”________mвҲ¶n(еЎ«вҖң>вҖқгҖҒвҖңпјқвҖқжҲ–вҖңпјңвҖқ)гҖӮ
|
|||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
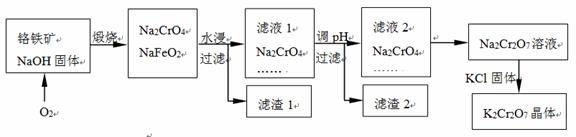
铬й“Ғзҹҝзҡ„дё»иҰҒжҲҗеҲҶеҸҜиЎЁзӨәдёәFeOВ·Cr2O3пјҢиҝҳеҗ«жңүSiO2гҖҒAl2O3зӯүжқӮиҙЁпјҢд»Ҙ铬й“ҒзҹҝдёәеҺҹж–ҷеҲ¶еӨҮйҮҚ铬酸й’ҫпјҲK2Cr2O7пјүзҡ„иҝҮзЁӢеҰӮдёӢеӣҫжүҖзӨәгҖӮ е·ІзҹҘпјҡв‘ NaFeO2йҒҮж°ҙејәзғҲж°ҙи§ЈгҖӮВ В в‘Ў Cr2O72пјҚ+ H2O
з”ҹжҲҗж»ӨжёЈ1дёӯзәўиӨҗиүІзү©иҙЁеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ ж»Өж¶І1зҡ„жҲҗеҲҶйҷӨNa2CrO4гҖҒNa2SiO3еӨ–пјҢиҝҳеҗ«жңүпјҲеЎ«еҢ–еӯҰејҸпјүВ В В В В В В В В В В В В В В В В В В В гҖӮ еҲ©з”Ёж»ӨжёЈ2пјҢеҸҜеҲ¶еҫ—дёӨз§Қж°§еҢ–зү©пјҢе…¶дёӯдёҖз§Қж°§еҢ–зү©з»Ҹз”өи§ЈеҶ¶зӮјеҸҜиҺ·еҫ—йҮ‘еұһпјҢиҜҘз”өи§ЈеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ з”ұж»Өж¶І2иҪ¬еҢ–дёәNa2Cr2O7жә¶ж¶Іеә”йҮҮеҸ–зҡ„жҺӘж–ҪжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ еҗ‘Na2Cr2O7жә¶ж¶ІдёӯеҠ е…ҘKClеӣәдҪ“пјҢиҺ·еҫ—K2Cr2O7жҷ¶дҪ“зҡ„ж“ҚдҪңдҫқж¬ЎжҳҜпјҡеҠ зғӯжө“зј©гҖҒВ В В В В гҖҒиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘгҖӮ з……зғ§й“¬й“Ғзҹҝз”ҹжҲҗNa2CrO4е’ҢNaFeO2еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
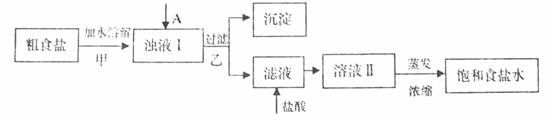
йЈҹзӣҗжҳҜж—Ҙеёёз”ҹжҙ»зҡ„еҝ…йңҖе“ҒпјҢд№ҹжҳҜйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷгҖӮ пјҲ1пјүзІ—йЈҹзӣҗеёёеҗ«жңүе°‘йҮҸ
жҸҗдҫӣзҡ„иҜ•еүӮпјҡйҘұе’Ң пјҲ1пјүв‘ ж¬ІйҷӨеҺ»жөҠж¶ІIдёӯзҡ„ в‘ЎеҠ зӣҗй…ёзҡ„зӣ®зҡ„жҳҜпјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәпјүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ўеҰӮжһңеңЁе®һйӘҢе®Өдёӯе®ҢжҲҗдёӢеҲ—иҝҮзЁӢпјҢз”ІгҖҒд№ҷдёӨдёӘиҝҮзЁӢеқҮиҰҒз”ЁеҲ°зҺ»з’ғжЈ’пјҢзҺ»з’ғжЈ’зҡ„дҪңз”ЁеҲҶеҲ«жҳҜ з”ІВ В В В В В В пјҢд№ҷВ В В В В В В В гҖӮ пјҲ2пјүе·ҘдёҡдёҠз”Ёжғ°жҖ§з”өжһҒз”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙеҲ¶еҸ–зӣҗй…ёпјҢеҶҷеҮәз”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙзҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣз”ЁиҜ•зәёжЈҖйӘҢз”өи§ЈйЈҹзӣҗж°ҙйҳіжһҒдә§зү©зҡ„ж–№жі•жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
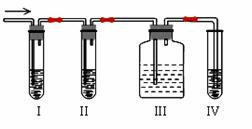
д№ҷзғҜжҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢжҲ‘们已еӯҰиҝҮз”ЁдёӨз§Қж–№жі•еҲ¶еҫ—д№ҷзғҜпјҡ AпјҺеңЁе®һйӘҢе®ӨйҮҢз”Ёд№ҷйҶҮдёҺжө“зЎ«й…ёе…ұзғӯеҲ¶д№ҷзғҜпјҢеёёеӣ жё©еәҰиҝҮй«ҳиҖҢдҪҝд№ҷйҶҮе’Ңжө“зЎ«й…ёеҸҚеә”з”ҹжҲҗе°‘йҮҸзҡ„дәҢж°§еҢ–зЎ«пјҢжңүдәәи®ҫи®ЎдёӢеҲ—е®һйӘҢеӣҫд»ҘзЎ®и®ӨдёҠиҝ°ж··еҗҲж°”дҪ“дёӯжңүC2H4е’ҢSO2гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүIгҖҒIIгҖҒIIIгҖҒIVиЈ…зҪ®еҸҜзӣӣж”ҫзҡ„иҜ•еүӮжҳҜIВ В В В В пјӣII В В В В В пјӣ IIIВ В В В пјӣIVВ В В В В (е°ҶдёӢеҲ—жңүе…іиҜ•еүӮзҡ„еәҸеҸ·еЎ«е…Ҙз©әж јеҶ…пјүгҖӮ AпјҺе“Ғзәўжә¶ж¶ІВ В BпјҺNaOHжә¶ж¶І В В CпјҺжө“зЎ«й…ёВ В DпјҺй…ёжҖ§KMnO4жә¶ж¶І пјҲ2пјүиғҪиҜҙжҳҺSO2ж°”дҪ“еӯҳеңЁзҡ„зҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүзЎ®е®ҡеҗ«жңүд№ҷзғҜзҡ„зҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүеҶҷеҮәз”ҹжҲҗд№ҷзғҜзҡ„еҸҚеә”ж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ BпјҺдёәжЈҖйӘҢеҲ©з”Ёжәҙд№ҷзғ·еҸ‘з”ҹж¶ҲеҺ»еҸҚеә”еҗҺз”ҹжҲҗзҡ„ж°”дҪ“дёӯжҳҜеҗҰеҗ«д№ҷзғҜзҡ„иЈ…зҪ®еҰӮеӣҫжүҖзӨәгҖӮеӣһзӯ”пјҡ
пјҲ1пјүеҲ©з”Ёжәҙд№ҷзғ·еҸ‘з”ҹж¶ҲеҺ»еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡВ В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиҜ•з®Ўaзҡ„дҪңз”ЁжҳҜ В В В В В В В В В В В В В В В В В пјӣиӢҘзңҒеҺ»иҜ•з®ЎaпјҢиҜ•з®ЎbдёӯиҜ•еүӮдёәВ В В В В В В В В В В В В В гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
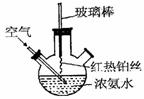
дёүйўҲ瓶еңЁеҢ–еӯҰе®һйӘҢдёӯзҡ„еә”з”Ёйқһеёёе№ҝжіӣпјҢдёӢйқўжҳҜдёүйўҲ瓶еңЁйғЁеҲҶж— жңәе®һйӘҢжҲ–жңүжңәе®һйӘҢдёӯзҡ„дёҖдәӣеә”з”ЁгҖӮ пјҲ1пјүеңЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®дёӯпјҢиҝӣиЎҢж°Ёзҡ„еӮ¬еҢ–ж°§еҢ–е®һйӘҢпјҡеҗ‘дёүйўҲ瓶еҶ…зҡ„жө“ж°Ёж°ҙдёӯдёҚж–ӯйҖҡе…Ҙз©әж°”пјҢе°Ҷзәўзғӯзҡ„й“ӮдёқжҸ’е…Ҙ瓶еӯҗ并жҺҘиҝ‘ж¶ІйқўгҖӮеҸҚеә”иҝҮзЁӢдёӯеҸҜи§ӮеҜҹеҲ°з“¶дёӯжңүзәўжЈ•иүІж°”дҪ“дә§з”ҹпјҢй“Ӯдёқе§Ӣз»ҲдҝқжҢҒзәўзғӯгҖӮе®һйӘҢиҝҮзЁӢдёӯ
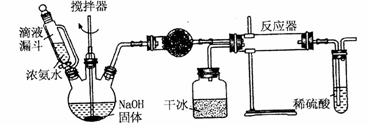
пјҲ2пјүе®һйӘҢе®Өз”ЁдёӢеӣҫжүҖзӨәиЈ…зҪ®еҲ¶еӨҮж°Ёеҹәз”Ій…ёй“өпјҲ
иҜҘеҸҚеә”еңЁе№ІзҮҘжқЎд»¶дёӢд»…з”ҹжҲҗж°Ёеҹәз”Ій…ёй“өпјҢиӢҘжңүж°ҙеӯҳеңЁеҲҷз”ҹжҲҗзўій…ёй“өжҲ–зўій…ёж°ўй“өгҖӮ
в‘ еҶҷеҮәеҠ е…ҘиҚҜе“Ғд№ӢеүҚе®һйӘҢж“ҚдҪңзҡ„иҰҒзӮ№_______пјӣеҸҚеә”дёӯиӢҘжңүж°ҙеӯҳеңЁеҲҷз”ҹжҲҗзўій…ёж°ўй“өзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ________________________гҖӮ в‘Ўе№ІзҮҘз®Ўдёӯзӣӣж”ҫзҡ„иҚҜе“ҒжҳҜ______гҖӮз®Җиҝ°е·Ұдҫ§дёүйўҲ瓶装зҪ®еҲ¶еҸ–ж°Ёж°”зҡ„еҺҹзҗҶ________гҖӮ в‘ўеҜ№жҜ”зўій…ёзӣҗе’Ңй…ёзҡ„еҸҚеә”еҲ¶еҸ– в‘ЈжңүеҗҢеӯҰи®ӨдёәиҜҘе®һйӘҢиЈ…зҪ®еӯҳеңЁе®үе…Ёй—®йўҳпјҢиҜ·й—®еҸҜиғҪйқўдёҙзҡ„е®үе…Ёй—®йўҳжҳҜ________гҖӮ в‘Өж°Ёеҹәз”Ій…ёж°ЁеҸҜз”ЁдҪңиӮҘж–ҷпјҢе…¶иӮҘж•ҲжҜ”е°ҝзҙ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
в… жҹҗж°”жҖҒзғғеҗ«зўі85.7%гҖҒеҗ«ж°ў14.3%пјҢеңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„еҜҶеәҰжҳҜ2.5 g/LпјҢиҜҘзғғиғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІжҲ–жәҙж°ҙиӨӘиүІгҖӮ (1)иҜҘзғғеҲҶеӯҗејҸдёә_______________________гҖӮ (2)еҶҷеҮәе®ғзҡ„еҗ„з§ҚеҗҢеҲҶејӮжһ„дҪ“зҡ„з»“жһ„з®ҖејҸпјҡ __________________________________гҖӮ в…Ўе°Ҷ44.8 gй“ңдёҺ140 mLдёҖе®ҡжө“еәҰзҡ„зЎқй…ёеҸҚеә”пјҢй“ңе®Ңе…Ёжә¶и§ЈпјҢдә§з”ҹзҡ„NOе’ҢNO2ж··еҗҲж°”дҪ“еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§Ҝдёә11. 2LиҜ·еӣһзӯ”пјҡ (1)ж ҮеҶөдёӢпјҢNO2зҡ„дҪ“з§Ҝдёә В В В В В L (2)еҫ…дә§з”ҹзҡ„ж°”дҪ“е…ЁйғЁйҮҠж”ҫеҗҺпјҢеҗ‘жә¶ж¶ІдёӯеҠ е…ҘV mL a mol/Lзҡ„NaOHжә¶ж¶ІпјҢжҒ°еҘҪдҪҝжә¶ж¶Ідёӯзҡ„Cu2+е…ЁйғЁиҪ¬еҢ–жҲҗжІүж·ҖпјҢеҲҷеҺҹзЎқй…ёжә¶ж¶Іжө“еәҰдёәВ В В В пјҲеЎ«иЎЁиҫҫејҸпјү (3)ж¬ІдҪҝй“ңдёҺзЎқй…ёеҸҚеә”з”ҹжҲҗзҡ„ж°”дҪ“дёҺO2е’ҢH2Oе…ЁйғЁиҪ¬еҢ–дёәHNO3пјҢиҮіе°‘иҰҒO2В g
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
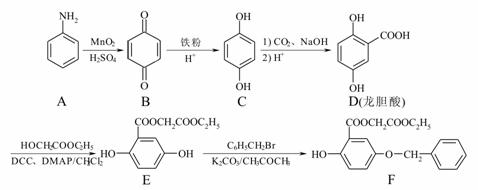
йӮ»иӢҜдәҢз”Ій…ёдәҢд№ҷй…Ҝ
е·ІзҹҘд»ҘдёӢдҝЎжҒҜпјҡ в‘ жңүжңәеҢ–еҗҲзү©AеҸҜз”ЁжқҘеӮ¬зҶҹж°ҙжһңгҖӮ в‘ЎжңүжңәеҢ–еҗҲзү©Cзҡ„ж ёзЈҒе…ұжҢҜж°ўи°ұжҳҫзӨәе…¶жңү3з§ҚдёҚеҗҢеҢ–еӯҰзҺҜеўғзҡ„ж°ўеҺҹеӯҗгҖӮ
пјҲ1пјүAзҡ„еҢ–еӯҰеҗҚз§°жҳҜВ В В В В В В В В В В В В В пјҢBзҡ„з»“жһ„з®ҖејҸдёәВ В В В В В В В В В В В В В гҖӮ пјҲ2пјүеҸҚеә”в…Ўзҡ„иҜ•еүӮжҳҜВ В В В В В В В В В В В В В В пјҢиҜҘеҸҚеә”зұ»еһӢдёәВ В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүCз”ҹжҲҗDзҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүEз”ҹжҲҗFзҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ5пјүеңЁGзҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯпјҢж—ўиғҪдёҺж–°еҲ¶зҡ„Cu(OH)2жӮ¬жөҠж¶ІеңЁеҠ зғӯжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗз –зәўиүІжІүж·ҖпјҢеҸҲиғҪдёҺзўій…ёй’ еҸҚеә”з”ҹжҲҗдәҢж°§еҢ–зўіпјҢиҝҳиғҪдҪҝFeCl3жә¶ж¶ІжҳҫиүІзҡ„жңүВ В В В В В В В В з§ҚпјҢжүҖжңүиҝҷдәӣеҗҢеҲҶејӮжһ„дҪ“дёӯпјҢдёҚеҗҢеҢ–еӯҰзҺҜеўғж°ўеҺҹеӯҗзҡ„з§Қж•°В В В В В В В (еЎ«вҖңзӣёеҗҢвҖқвҖңдёҚзӣёеҗҢвҖқ)гҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
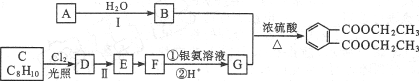
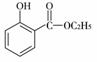
йҫҷиғҶй…ёзғ·еҹәй…Ҝзұ»FжҳҜдёҖз§ҚиҚҜзү©зҡ®иӮӨзҫҺзҷҪеүӮпјҢеҗҲжҲҗи·ҜзәҝеҰӮдёӢпјҡ
пјҲ1пјүDпјҲйҫҷиғҶй…ёпјүдёӯеҗ«ж°§е®ҳиғҪеӣўзҡ„еҗҚз§°дёәВ В В В В В В гҖҒВ В В В В В В гҖӮ пјҲ2пјүE пјҲ3пјүеҶҷеҮәD пјҲ4пјүеҶҷеҮәж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„йҫҷиғҶй…ёд№ҷй…ҜпјҲ в… .иғҪеҸ‘з”ҹ银й•ңеҸҚеә”пјҢдёҺFeCl3дёҚеҸ‘з”ҹжҳҫиүІеҸҚеә”дҪҶе…¶ж°ҙи§Јдә§зү©д№ӢдёҖиғҪдёҺFeCl3жә¶ж¶ІеҸ‘з”ҹжҳҫиүІеҸҚеә”гҖӮ в…Ў.ж ёзЈҒе…ұжҢҜж°ўи°ұжңүеӣӣз»„еі°пјҢдё”еі°зҡ„йқўз§Ҝд№ӢжҜ”дёә6:2:1:1гҖӮ пјҲ5пјүе·ІзҹҘпјҡ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
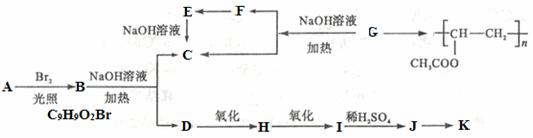
иҒҡд№ҷй…ёд№ҷзғҜй…Ҝе№ҝжіӣз”ЁдәҺеҲ¶еӨҮж¶Ӯж–ҷгҖҒзІҳеҗҲеүӮзӯүпјҢе®ғе’Ңй«ҳиҒҡзү©Kзҡ„еҗҲжҲҗи·ҜзәҝеҰӮдёӢпјҡ е…¶дёӯJзү©иҙЁдёҺж°ҜеҢ–й“Ғжә¶ж¶ІиғҪеҸ‘з”ҹжҳҫиүІеҸҚеә”,дё”иӢҜзҺҜдёҠзҡ„дёҖе…ғеҸ–д»Јзү©еҸӘжңүдёӨз§ҚгҖӮ е·ІзҹҘпјҡв‘ еҪ“зҫҹеҹәдёҺеҸҢй”®зўіеҺҹеӯҗзӣёиҝһж—¶пјҢжҳ“еҸ‘з”ҹеҰӮдёӢиҪ¬еҢ–RCH =CHOHвҶ’RCH2CHO в‘ЎвҖ”ONaиҝһеңЁзғғеҹәдёҠдёҚдјҡиў«ж°§еҢ– иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳ: пјҲ1пјүеҶҷеҮәGзҡ„з»“жһ„з®ҖејҸ_______________гҖӮFдёҺHдёӯе…·жңүзҡ„зӣёеҗҢе®ҳиғҪеӣўеҗҚз§°дёә__________гҖӮ пјҲ2пјүдёҠиҝ°еҸҳеҢ–дёӯGвҶ’C+F зҡ„еҸҚеә”зұ»еһӢжҳҜ__________________пјӣJеңЁдёҖе®ҡжқЎд»¶дёӢиғҪз”ҹжҲҗй«ҳиҒҡзү©KпјҢKзҡ„з»“жһ„з®ҖејҸжҳҜ________________________гҖӮ пјҲ3пјүеҶҷеҮәBвҶ’C+DеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ________________________________________гҖӮ пјҲ4пјүеҗҢж—¶з¬ҰеҗҲдёӢеҲ—иҰҒжұӮзҡ„Aзҡ„еҗҢеҲҶејӮжһ„дҪ“жңү_____________з§ҚгҖӮ IгҖҒеҗ«жңүиӢҜзҺҜпјӣВ В IIгҖҒиғҪеҸ‘з”ҹ银й•ңеҸҚеә”е’Ңж°ҙи§ЈеҸҚеә”пјӣ еңЁиҝҷдәӣеҗҢеҲҶејӮжһ„дҪ“дёӯпјҢж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„еҗҢеҲҶејӮжһ„дҪ“зҡ„з»“жһ„з®ҖејҸдёә______________________гҖӮ в‘ ж ёзЈҒе…ұжҢҜж°ўи°ұжңү5дёӘеҗёж”¶еі° пјӣВ В В в‘Ў1molиҜҘеҗҢеҲҶејӮжһ„дҪ“иғҪдёҺ1mol NaOH еҸҚеә” пјҲ5пјүдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜ___________________гҖӮ aпјҺ1 mol A е®Ңе…ЁзҮғзғ§ж¶ҲиҖ—10пјҺ5 mol O2 bпјҺJдёҺи¶ійҮҸзҡ„зўій…ёж°ўй’ жә¶ж¶ІеҸҚеә”иғҪз”ҹжҲҗзӣёеә”зҡ„дәҢй’ зӣҗ cпјҺDвҶ’H зҡ„иҜ•еүӮйҖҡеёёжҳҜKMnO4й…ёжҖ§жә¶ж¶І dпјҺJиғҪеҸ‘з”ҹеҠ жҲҗгҖҒж¶ҲеҺ»гҖҒеҸ–д»ЈгҖҒж°§еҢ–зӯүеҸҚеә”
|
|
- 2018иҮі2019е№ҙй«ҳдёҖеҢ–еӯҰеҝ…дҝ®дәҢ第3з« йҮҚиҰҒзҡ„жңүжңәеҢ–еҗҲзү© з« жң«з»јеҗҲжЈҖжөӢпјҲйІҒж•ҷзүҲпјү
- дёҠжө·еёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•жЁЎжӢҹиҖғиҜ•з»ғд№
- зҺүжәӘ第дёҖдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- жұҹиӢҸзңҒеҚ—йҖҡеёӮжө·й—ЁдёӯеӯҰ2021еұҠй«ҳдёү12жңҲиҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- жҙӣйҳіеёӮ2019е№ҙй«ҳдәҢеҢ–еӯҰдёӢеӯҰжңҹжңҲиҖғжөӢйӘҢеҗҢжӯҘз»ғд№
- 2019-2020е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲеҗүжһ—зңҒеҗүжһ—еёӮ第дә”еҚҒдә”дёӯеӯҰпјү
- еӨ©жҙҘеёӮ2019е№ҙй«ҳдёҖдёҠжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢзҪ‘дёҠиҖғиҜ•з»ғд№
- еұұдёң2020е№ҙй«ҳдёүеҢ–еӯҰдёҠеҚҠе№ҙйҷ„зӯ”жЎҲдёҺи§Јжһҗ