2019ж№–еҚ—й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁпјҢжҢүеҢ–еҗҲзү©гҖҒеҚ•иҙЁгҖҒж··еҗҲзү©зҡ„йЎәеәҸжҺ’еҲ—зҡ„жҳҜпјҲВ В пјү AпјҺзғ§зўұгҖҒж¶ІжҖҒж°§гҖҒзўҳй…’В В В В В В В BпјҺз”ҹзҹізҒ°гҖҒзҷҪзЈ·гҖҒзҶҹзҹізҒ° CпјҺе№ІеҶ°гҖҒй“ҒгҖҒж°ҜеҢ–ж°ўВ В В В В В В В В DпјҺз©әж°”гҖҒж°®ж°”гҖҒиғҶзҹҫ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеұһдәҺз”өи§ЈиҙЁзҡ„жҳҜпјҲВ В пјү AпјҺй“ңВ В В В В В В В BпјҺйЈҹзӣҗж°ҙВ В В В В В В В CпјҺзғ§зўұВ В В В В DпјҺи”—зі–
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„ж··еҗҲзү©дёӯ,иғҪз”ЁеҲҶж¶ІжјҸж–—иҝӣиЎҢеҲҶзҰ»зҡ„жҳҜ(гҖҖ) В AпјҺж°ҙе’ҢCCl4В В В В В В В В BпјҺй…’зІҫе’Ңж°ҙВ В В В В В В В В В В В В В В В CпјҺзўҳе’ҢCCl4В В В В В В В В В В В В В В В В В В В DпјҺжұҪжІ№е’ҢжӨҚзү©жІ№
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰж–№зЁӢејҸдёӯпјҢдёҚиғҪз”ЁзҰ»еӯҗж–№зЁӢејҸBa2+В + SO42вҖ”В = BaSO4вҶ“иЎЁзӨәзҡ„жҳҜпјҲВ В пјү AпјҺBa(NO3)2 +H2SO4= BaSO4вҶ“+2HNO3В В В В В В В В В BпјҺBaCl2+ Na2SO4= BaSO4вҶ“+2 NaCl CпјҺBaCO3 + H2SO4= BaSO4вҶ“+ H2O+CO2вҶ‘В В В В DпјҺBaCl2+ H2SO4= BaSO4вҶ“+2HCl
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ійҷӨеҺ»жқӮиҙЁ(жӢ¬еҸ·еҶ…дёәжқӮиҙЁ)зҡ„ж“ҚдҪңдёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү A.зЎ«й…ёй’ (зўій…ёй’ҷ):еҠ ж°ҙжә¶и§ЈпјҢ然еҗҺиҝҮж»Ө B.зўій…ёй’ (еӨ§йҮҸж°ҙ):и’ёеҸ‘ C.ж°ҜеҢ–й’ (ж°ҜеҢ–й•Ғ):еҠ ж°ҙжә¶и§ЈпјҢ然еҗҺиҝҮж»Ө D.зЎ«й…ёй’Ў(зЎқй…ёй’Ў):еҠ ж°ҙжә¶и§ЈпјҢ然еҗҺи’ёеҸ‘
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҢжё©еҗҢеҺӢдёӢпјҢзӯүиҙЁйҮҸзҡ„дёӢеҲ—ж°”дҪ“жүҖеҚ жңүзҡ„дҪ“з§ҜжңҖеӨ§зҡ„жҳҜпјҲВ В пјү AпјҺH2В В BпјҺCO В В В CпјҺCH4В В DпјҺCO2
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ30 mL 0.5mol/Lзҡ„NaOHжә¶ж¶ІеҠ ж°ҙзЁҖйҮҠеҲ°500 mLпјҢзЁҖйҮҠеҗҺNaOHзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәпјҲВ В пјү AпјҺ0.3 mol/LВ В В В В В BпјҺ0.03 mol/L В В В В В CпјҺ0.05 mol/LВ В В В В В В В В DпјҺ0.04 mol/L
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёәдәҶйҷӨеҺ»зІ—зӣҗдёӯзҡ„Ca2+ гҖҒMg2+ гҖҒSO42-еҸҠжіҘжІҷпјҢеҸҜе°ҶзІ—зӣҗжә¶дәҺж°ҙпјҢ然еҗҺиҝӣиЎҢдёӢеҲ—дә”йЎ№ж“ҚдҪңгҖӮе…¶дёӯжӯЈзЎ®зҡ„жҳҜв‘ иҝҮж»Ө в‘Ў еҠ иҝҮйҮҸзҡ„NaOHжә¶ж¶І в‘ў еҠ йҖӮйҮҸзӣҗй…ё в‘ЈеҠ иҝҮйҮҸNa2CO3жә¶ж¶І в‘Ө еҠ иҝҮBaCl2 жә¶ж¶ІВ пјҲВ В пјүВ В В В В A.в‘ в‘Јв‘Ўв‘Өв‘ўВ В В В В В В B.в‘Јв‘ в‘Ўв‘Өв‘ўВ В В В В В C.в‘Ўв‘Өв‘Јв‘ в‘ўВ В В В В В В D.в‘Ўв‘Јв‘ в‘ўв‘Ө
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶ІдёӯCl- жө“еәҰдёҺ50mL 1molВ·Lп№Ј1 MgCl2жә¶ж¶ІдёӯCl- жө“еәҰзӣёзӯүзҡ„жҳҜпјҲгҖҖ пјү AпјҺ100mL 1 molВ·Lп№Ј1 NaClжә¶ж¶ІВ В В В В В В В В BпјҺ100 mL 1 molВ·Lп№Ј1 CaCl2жә¶ж¶І CпјҺ50 mL 2 molВ·Lп№Ј1 BaCl2жә¶ж¶ІВ В В В В В В В В DпјҺ50 mL 2 molВ·Lп№Ј1 AlCl3жә¶ж¶І
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ10.6g Na2CO3жә¶дәҺж°ҙй…ҚеҲ¶жҲҗ1000mLжә¶ж¶ІпјҢд»ҺдёӯеҸ–еҮә20mL,иҜҘжә¶ж¶ІдёӯNa+зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә AпјҺ0.1 mol/LВ В В В В В BпјҺ0.2 mol/L В В В В В CпјҺ0.05 mol/LВ В В В В В В В В DпјҺ0.025mol/L |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–дёӯпјҢйңҖиҰҒеҠ е…Ҙж°§еҢ–еүӮжүҚиғҪе®һзҺ°зҡ„жҳҜпјҲгҖҖгҖҖпјү A. KMnO4вҶ’MnCl2В В В В В В B. CuOвҶ’CuВ В В В C. CaCO3вҶ’CO2В В В В В D. FeвҶ’FeCl2 В В В |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„дёӯзҡ„зҰ»еӯҗпјҢиғҪеңЁж°ҙжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ В пјү AпјҺK+гҖҒH+гҖҒSO42вҖ”гҖҒOHвҖ”В В В В В В В В В В В В В BпјҺNa+гҖҒCa2+гҖҒCO32вҖ”гҖҒNO3вҖ” CпјҺNa+гҖҒH+гҖҒClвҖ”гҖҒCO32вҖ”В В В В В В В В В В В В В DпјҺNa+гҖҒCu2+гҖҒSO42вҖ”гҖҒClвҖ”
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
NAд»ЈиЎЁйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјгҖӮдёӢеҲ—жңүе…іNAзҡ„еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү В В В A. 1molд»»дҪ•зү©иҙЁжүҖеҗ«зҡ„еҲҶеӯҗж•°еқҮдёәNAдёӘ B. 14gж°®ж°”жүҖеҗ«зҡ„NеҺҹеӯҗж•°дёәNAдёӘ C. ж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 Lж°ҙжүҖеҗ«зҡ„H2OеҲҶеӯҗж•°дёәNAдёӘ D. еёёжё©еёёеҺӢдёӢпјҢ11.2 L CO2жүҖеҗ«зҡ„еҺҹеӯҗж•°дёә1.5NA
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ пјү В В В AпјҺи’ёеҸ‘ж—¶пјҢж®Ӣз•ҷзҡ„е°‘йҮҸж°ҙи®©дҪҷзғӯи’ёе№І BпјҺеҲҶж¶Іж—¶пјҢдёӢеұӮж¶ІдҪ“д»ҺдёӢз«Ҝж”ҫеҮәпјҢдёҠеұӮж¶ІдҪ“д»ҺдёҠз«ҜеҖ’еҮә CпјҺи’ёйҰҸж—¶пјҢеҶ·ж°ҙд»ҺеҶ·еҮқз®ЎдёҠеҸЈиҝӣдёӢеҸЈеҮә DпјҺиҝҮж»Өж—¶пјҢжјҸж–—дёӢз«Ҝзҙ§иҙҙзғ§жқҜеҶ…еЈҒ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸдёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺзЁҖзЎ«й…ёж»ҙеңЁй“ңзүҮдёҠпјҡCu + 2H+В = Cu2+В + H2вҶ‘ BпјҺж°§еҢ–й•ҒдёҺзЁҖзӣҗй…ёж··еҗҲпјҡMgO + 2H+В = Mg2++ H2O CпјҺй“ңзүҮжҸ’е…ҘзЎқ酸银жә¶ж¶ІдёӯпјҡCu + Ag+В = Cu2+В + Ag DпјҺй“ҒдёҺзЁҖзЎ«й…ёеҸҚеә”пјҡ 2 Fe В + 6H+В = 2Fe3+В + 3H2вҶ‘
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
иғ¶дҪ“гҖҒжөҠж¶ІдёҺжә¶ж¶Ізҡ„жң¬иҙЁеҢәеҲ«еңЁдәҺпјҲВ В пјү A. еҲҶж•Јзі»жҳҜеҗҰжңүдёҒиҫҫе°”зҺ°иұЎ B. еҲҶж•ЈиҙЁзІ’еӯҗжҳҜеҗҰеёҰз”өиҚ· C. еҲҶж•Јзі»жҳҜеҗҰзЁіе®ҡ D. еҲҶж•ЈиҙЁзІ’еӯҗзӣҙеҫ„зҡ„еӨ§е°Ҹ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
йҖүжӢ©дёӢеҲ—е®һйӘҢж–№жі•еҲҶзҰ»зү©иҙЁпјҢе°ҶеҲҶзҰ»ж–№жі•зҡ„еәҸеҸ·еЎ«еңЁжЁӘзәҝдёҠпјҡ A. В В иҗғеҸ–жі•В В В В В B. В з»“жҷ¶жі•В В В В В В C. В еҲҶж¶Іжі•В В В В В D. В и’ёйҰҸжі•В В В В В E.В иҝҮж»Өжі• В В В в‘Өд»Һж°ҜеҢ–й’ жә¶ж¶ІдёӯиҺ·еҫ—ж°ҜеҢ–й’ жҷ¶дҪ“_____
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
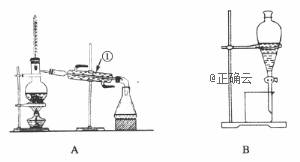
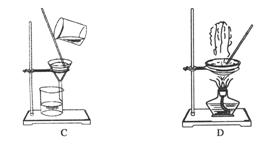
дёӢеӣҫжҳҜдёӯеӯҰеҢ–еӯҰдёӯеёёз”ЁдәҺж··еҗҲзү©зҡ„еҲҶзҰ»е’ҢжҸҗзәҜзҡ„иЈ…зҪ®пјҢиҜ·ж №жҚ®иЈ…зҪ®еӣһзӯ”й—®йўҳпјҡ
(1)д»Һж°ҜеҢ–й’ҫжә¶ж¶Ідёӯеҫ—еҲ°ж°ҜеҢ–й’ҫеӣәдҪ“пјҢйҖүжӢ©иЈ…зҪ®________(еЎ«д»ЈиЎЁиЈ…зҪ®еӣҫзҡ„еӯ—жҜҚпјҢдёӢеҗҢ)пјӣйҷӨиҮӘжқҘж°ҙдёӯзҡ„ClпјҚзӯүжқӮиҙЁпјҢйҖүжӢ©иЈ…зҪ®________________гҖӮ (2)д»Һзўҳж°ҙдёӯеҲҶзҰ»еҮәзўҳеҚ•иҙЁпјҢйҖүжӢ©иЈ…зҪ®________пјҢиҜҘеҲҶзҰ»ж–№жі•зҡ„еҗҚз§°дёә________________гҖӮ (3)иЈ…зҪ®Aдёӯв‘ зҡ„еҗҚз§°жҳҜ________пјҢеңЁж“ҚдҪңдёӯеҫҖи’ёйҰҸзғ§з“¶дёӯеҠ е…ҘжІёзҹізҡ„дҪңз”ЁжҳҜ________________гҖӮ иҝӣж°ҙзҡ„ж–№еҗ‘жҳҜд»Һ________еҸЈиҝӣж°ҙгҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
пјү(1)7.2gH2Oзҡ„зү©иҙЁзҡ„йҮҸжҳҜ_____molпјҢеҗ«жңү______дёӘH2OеҲҶеӯҗпјҢеҗ«жңү_____molз”өеӯҗгҖӮ (2)3пјҺ01Г—1022дёӘOHпјҚзҡ„зү©иҙЁзҡ„йҮҸдёә________molпјҢиҙЁйҮҸдёә________g_ (3)ж ҮеҮҶзҠ¶еҶөдёӢпјҢв‘ 1.7gж°Ёж°”гҖҒв‘Ў3.36 Lз”Ізғ·гҖҒв‘ў6пјҺ02Г—1022дёӘдәҢж°§еҢ–зўіеҲҶеӯҗпјҢеҗ«еҺҹеӯҗж•°жңҖеӨҡзҡ„жҳҜ(еЎ«еәҸеҸ·)________пјҢиҙЁйҮҸжңҖеӨ§зҡ„жҳҜ_________гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еҶҷеҮәдёӢеҲ—еҢ–еӯҰеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ (1)ж°§еҢ–й•Ғе’ҢзЎ«й…ёжә¶ж¶ІеҸҚеә”В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (2)й“Ғе’ҢзЎ«й…ёй“ңжә¶ж¶ІеҸҚеә”В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
В (1)жңүAгҖҒBгҖҒCгҖҒDеӣӣз§ҚеҢ–еҗҲзү©пјҢеҲҶеҲ«з”ұK+гҖҒBa2+гҖҒSO42-гҖҒCO32-гҖҒOHп№ЈдёӯдёӨз§Қз»„жҲҗпјҢе®ғ们具жңүдёӢеҲ—жҖ§иҙЁпјҡ в‘ AдёҚжә¶дәҺж°ҙе’Ңзӣҗй…ёпјӣВ в‘ЎBдёҚжә¶дәҺж°ҙдҪҶжә¶дәҺзӣҗ酸并ж”ҫеҮәж— иүІж— е‘ізҡ„ж°”дҪ“Eпјӣ в‘ўCзҡ„ж°ҙжә¶ж¶Іе‘ҲзўұжҖ§пјҢдёҺзЎ«й…ёеҸҚеә”з”ҹжҲҗAпјӣ в‘ЈDеҸҜжә¶дәҺж°ҙпјҢдёҺзЎ«й…ёдҪңз”Ёж—¶ж”ҫеҮәж°”дҪ“EпјҢEеҸҜдҪҝжҫ„жё…зҹізҒ°ж°ҙеҸҳжө‘жөҠпјҺВ В В В жҺЁж–ӯдёӢеҲ—зү©иҙЁзҡ„еҢ–еӯҰејҸпјҺ AгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖпјӣ CгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖпјӣ DгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖпјӣ еҶҷеҮәBдёҺзӣҗй…ёеҸҚеә”зҰ»еӯҗж–№зЁӢејҸпјҡгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ2пјүеңЁдёҖдёӘз”Ёй“қеҲ¶зҡ„жҳ“жӢүзҪҗеҶ…е……ж»ЎCO2ж°”дҪ“пјҢ然еҗҺеҫҖзҪҗеҶ…жіЁе…Ҙи¶ійҮҸзҡ„NaOHжә¶ж¶ІпјҢз«ӢеҚіз”Ёиғ¶еёғеҜҶе°ҒзҪҗеҸЈгҖӮз»ҸиҝҮдёҖж®өж—¶й—ҙеҗҺпјҢзҪҗеЈҒеҶ…еҮ№иҖҢзҳӘпјҢеҶҚиҝҮдёҖж®өж—¶й—ҙеҗҺпјҢзҳӘдәҶзҡ„зҪҗеЈҒйҮҚж–°йј“иө·жқҘгҖӮиҜ·з”ЁзҰ»еӯҗж–№зЁӢејҸи§ЈйҮҠзҪҗеЈҒеҶ…еҮ№иҖҢзҳӘ________________________________________гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNaOHеӣәдҪ“й…ҚеҲ¶500mLВ 1.0mol/Lзҡ„NaOHжә¶ж¶ІпјҢж“ҚдҪңжӯҘйӘӨеҰӮдёӢпјҡ в‘ жҠҠз§°еҘҪзҡ„NaOHеӣәдҪ“ж”ҫе…Ҙе°Ҹзғ§жқҜдёӯпјҢеҠ йҖӮйҮҸи’ёйҰҸж°ҙжә¶и§ЈпјҢеҶ·еҚҙиҮіе®Өжё©пјӣ в‘Ўе®ҡе®№еҗҺпјҢеҠ зӣ–еҖ’иҪ¬ж‘ҮеҢҖеҗҺпјҢеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢеҸҲж»ҙеҠ и’ёйҰҸж°ҙиҮіеҲ»еәҰгҖӮеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰзҡ„еҪұе“Қпјҡ__________пјӣе®ҡе®№ж—¶дҝҜи§Ҷж¶ІйқўгҖӮеҜ№жүҖй…Қжә¶ж¶Іжө“еәҰзҡ„еҪұе“Қпјҡ__________
|
|
- дёҠжө·еёӮ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•ж— зәёиҜ•еҚ·
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲе®ҒеӨҸй•ҝеәҶй«ҳзә§дёӯеӯҰпјү
- ж°ёжҳҢеӣӣдёӯй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- еӣӣе·қзңҒе°„жҙӘдёӯеӯҰж Ў2020-2021е№ҙй«ҳдәҢдёҠеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲ
- еҢ—дә¬еёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•з»ғд№
- еҗ•жўҒеёӮй«ҳдёүеҢ–еӯҰ2018е№ҙдёҠеҚҠе№ҙй«ҳиҖғжЁЎжӢҹиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- е®ҒеӨҸзҹіеҳҙеұұеёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳеҗҢжӯҘи®ӯз»ғ
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•еҲ·йўҳи®ӯз»ғ