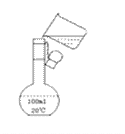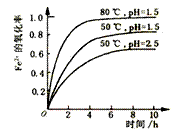2018北京高一上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下面是一些常用的危险品标志,装运乙醇的包装箱应贴上的图标是
A B C D
|
|
| 2. | 详细信息 |
|
下列仪器中,能直接加热的是 A. 烧杯 B. 烧瓶 C. 试管 D. 容量瓶
|
|
| 3. | 详细信息 |
|
下列操作中正确的是 A. 用酒精萃取碘水中的碘 B. 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 C. 将浓硫酸慢慢注入盛有水的烧杯中进行稀释,并不断搅拌 D. 配制1.00 mol/L NaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解
|
|
| 4. | 详细信息 |
|
下列关于胶体的叙述不正确的是 A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在10﹣9~10﹣7m之间 B. 光线透过胶体时,胶体可发生丁达尔效应 C. 将氯化铁浓溶液与氢氧化钠浓溶液混合,能得到Fe( D. Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
|
|
| 5. | 详细信息 |
|
下列说法中正确的是 A. 含有不同种元素的纯净物叫做化合物 B. 水溶液中能电离出H+的化合物一定是酸 C. 盐中一定含有金属元素 D. 非金属氧化物一定是酸性氧化物
|
|
| 6. | 详细信息 | |||||||||||||||||||||||||
|
下列各组关于强电解质、弱电解质、非电解质、混合物的归类,完全正确的是
|
||||||||||||||||||||||||||
| 7. | 详细信息 | |||||||||||||||
|
完成下列实验所选择的装置或仪器(A、B中夹持装置已略去)不正确的是
|
||||||||||||||||
| 8. | 详细信息 |
|
以下三组溶液:①煤油和硫酸钾溶液 ②42%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是 A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液 C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
|
|
| 9. | 详细信息 |
|
在酸性溶液中能大量共存而且溶液为无色透明的是 A. NH4+、Al3+、SO42-、NO3- B. K+、Na+、SO42-、Ba2+ C. K+、MnO4-、NH4+、Cl- D. Ca2+、K+、HCO3-、NO3-
|
|
| 10. | 详细信息 |
|
下列离子方程式的书写正确的是 A. 氢氧化铜和稀盐酸反应:H+ + OH- = H2O B. 氢氧化钡溶液与硫酸镁溶液混合:Ba2++SO42- = BaSO4↓ C. 向碳酸氢钠溶液中滴加稀盐酸:CO32- + 2H+ = H2O + CO2↑ D. 氧化铁与稀盐酸混合:Fe2O3 + 6H+ = 2Fe3+ + 3H2O
|
|
| 11. | 详细信息 |
|
下列溶液中的c(Cl-)与150 mL 1mol/L AlCl3溶液中的c(Cl-)相等的是 A. 150 mL 1 mol/L NaCl溶液 B. 25 mL 3 mol/L NH4Cl溶液 C. 75 mL 2 mol/L MgCl2溶液 D. 75 mL 2 mol/L FeCl3溶液
|
|
| 12. | 详细信息 |
|
下列说法正确的是 A. 取少量待测液,加入BaCl2 溶液,产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- B. 取少量待测液,加入AgNO3 溶液,产生白色沉淀, 则原溶液中一定有Cl- C. 取少量待测液,加入稀盐酸,产生无色无味并能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32- D. 为分别检验某溶液中含有的Cl-和SO42-,检出的顺序应为先检验SO42-后检验Cl-
|
|
| 13. | 详细信息 |
|
设NA代表阿伏加德罗常数的数值,下列说法正确的是 A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA B. 常温常压下,1 mol氮气含有的核外电子数为28NA C. 48g O2和O3的混合气体所含原子数为3NA D. 标准状况下,11.2 L四氯化碳含有的分子数为0.5NA
|
|
| 14. | 详细信息 |
|
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是 A. 16g B. 32g C. 64g /mol D. 32g /mol
|
|
| 15. | 详细信息 |
|
物质的量浓度相同的NaCl、MgCl2、AlCl3三种物质的溶液,当溶液的体积比为3∶2∶1 时,它们与同一浓度的AgNO3溶液恰好反应,则消耗的AgNO3溶液的体积比是 A. 3∶4∶3 B. 1∶1∶1 C. 1∶2∶3 D. 3∶2∶1
|
|
| 16. | 详细信息 |
|
氮化铝(AlN)是一种具有耐高温、抗冲击、导热性好等优良性质的物质,被广泛应用于电子工业、陶瓷工业。在一定条件下,氮化铝可通过如下反应合成:
下列叙述正确的是
B. 在该反应中,每当生成2mol AlN,N2失去 C. 氮化铝中氮元素的化合价为-3价 D. AlN既是氧化产物又是还原产物
|
|
| 17. | 详细信息 |
|
已知氧化还原反应:2Cu(IO3)2 + 24KI + 12H2SO4 =2CuI↓+ 13I2 +12K2SO4 +12H2O。当有1mol Cu(IO3)2参加反应时 A. 有12 mol KI 被氧化 B. 转移11 mol电子 C. 生成CuI 382g D. I2只是氧化产物
|
|
| 18. | 详细信息 |
|
已知只有符合以下规律的氧化还原反应才能够自发进行,即氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。若下面三个离子反应都能发生: 2A-+C2=2C-+A2,2C-+B2=2B-+C2,2X-+C2=2C-+X2,则下列有关说法中不正确的是 A. 氧化性B2>C2>A2 B. X2与B- 能发生反应 C. 氧化性B2>C2>X2 D. 还原性X- >C- >B-
|
|
| 19. | 详细信息 |
|
相等物质的量的KClO3分别发生下述反应: ①有MnO2催化剂存在时,受热分解得到O2和KCl; ②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl。 下列关于①和②的说法不正确的是 A. 都属于氧化还原反应 B. 发生还原反应的元素相同 C. 发生氧化反应的元素不同 D. 生成KCl的物质的量相同
|
|
| 20. | 详细信息 |
|
若24g SO32- 恰好与50mL 2mol/L的R2O72-溶液发生氧化还原反应,其中SO32-→SO42-,则R元素在还原产物中的化合价是 A. +1 B. +2 C. +3 D. +4
|
|
| 21. | 详细信息 |
|
酸性溶液中,Fe2+会被空气缓慢氧化
A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大 C. Fe2+的氧化率仅与溶液的pH和温度有关 D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
|
|
| 22. | 详细信息 |
|
在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度,利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是 A. ④⑤⑥ B. ①②③④ C. ①④⑥ D. ①③④⑤
|
|
| 23. | 详细信息 |
|
2008年5月,我国四川地区发生特大地震灾害,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。氯气(Cl2)是制备消毒剂的主要原料之一。工业上主要采用电解饱和食盐水的方法来制取Cl2。请回答下列问题: (1)电解之前,食盐水需要精制,目的是除去粗盐的中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂 (2)实验室欲配制6.00 mol/L的食盐水90 mL, ①需要纯净的NaCl g。 ②可供选择的仪器有:a玻璃棒 b烧瓶 c烧杯 d胶头滴管 e试管 f托盘天平、砝码 h药匙。在配制食盐水时不需要使用的 ③配制溶液时,一般可以分为以下几个 定容 装瓶 ④下列操作会使所配溶液的浓度偏小的是 。 A. 转移完溶液后未洗涤玻璃棒和烧杯 B. 容量瓶中原来有少量蒸馏水 C. 定容时,俯视刻度线 D. 称量氯化钠固体时左码右物 (3)在电解饱和食盐水过程中,还生成了H2和NaOH,则所发生反应的化学反应方程式为 ; (4)将电解生成的Cl2通入NaOH溶液,生成两种盐,其中一种是消毒液的主要成分NaClO,应用氧化还 |
|
| 24. | 详细信息 | ||||||||||||
|
某小组同学为探究物质的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。 已知:(1)溴水为溴的水溶液,溴水为橙黄色,溴蒸气为红棕色,均有毒
实验记录如下:
请回答下列问题: (1)A中反应的离子方程式是 。 (2)实验操作II吹入热空气的目的是 。 (3)装置C的作用是 。 (4)实验操作III,混合液逐渐变成橙黄色,其对应的离子方程式是 。 (5)由操作I得出的结论是 ,由操作III得出的结论是 。 (6)实验反思:实验操作III,开始时颜色无明显变化的原因是(写出一条即可):___________。
|
|||||||||||||
| 25. | 详细信息 | ||||||||||||||||||||||||||
|
在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。
已知:(1)SiO32-和大量的H+会生成白色沉淀H2SiO3; (2) (3)产生气体为在标准状况下测定,不考虑气体在水中的溶解。 现取该溶液100 mL进行如下实验:
请回答下列问题: (1)实验Ⅰ能确定一定不存在的离子是 (2)实验Ⅰ中生成沉淀的离子方程式为______________________。 (3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_________________。
|
|||||||||||||||||||||||||||
| 26. | 详细信息 |
|
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
(1)Ⅰ中发生反应的还原剂是 、Ⅱ中的氧化剂是 (填化学式)。 (2)Ⅱ中反应的离子方程式是 。 (3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: 5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。 ①该反应中氧化剂和还原剂的物质的量之比是 。 ②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。 请推测其原因是 。
|
|
| 27. | 详细信息 |
|
15.8g KMnO4氧化密度为1.19 g/cm3,溶质质 2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O (1)该盐酸中HCl的物质的量浓度是 (2)被氧化的HCl的物质的量为 。 (3)求产生的Cl 2在标准状况下的体积(依据化学方程式进行计算,要求写出计算过程)。
|
|