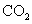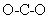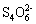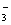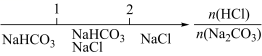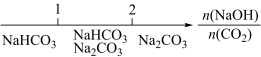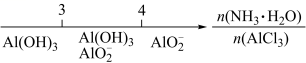辽宁省2020-2021学年高一上学期期末考试化学试题含解析
| 1. | 详细信息 |
|
新材料问世常常带动新科技、新技术的应用和发展,下列有关说法不正确的 A . 中国的航空铝材处于世界领先的行列,该铝材是纯度很高的铝,密度小,强度高 B . 稀土元素被称为 “ 冶金工业的维生素 ” ,其加入钢中后可增加钢的韧性、抗氧化性 C . “神舟”六号载人飞船表面覆盖某种特殊材料,这种材料强度高,耐高温 D . 2017 年 8 月我国宣布成功完成了某超级钢的研制,超级钢从组成看上是混合物 |
|
| 2. | 详细信息 |
|
NaCl 是我们生活中必不可少的物质。将 NaCl 固体溶于水,溶解过程如图所示,下列说法正确的是 A . 该过程发生了分解反应 B . 水若足量, Na + 和 Cl - 也不会完全成为水合离子状态 C . 水合 Na + 的图示不科学 D . NaCl 溶于水后发生了电离,是在通电条件下进行的 |
|
| 3. | 详细信息 |
|
磁流体是电子材料的新秀。在一定条件下,将含等物质的量的 FeSO 4 和 Fe 2 (SO 4 ) 3 的溶液混合,再滴入稍过量的 NaOH 溶液,可得到分散质粒子大小在 36 - 55nm 之间的黑色磁流体。下列说法中正确的 A . 所得的分散系属于悬浊液 B . 用一束光照射该分散系能产生丁达尔效应 C . 所得的分散系中分散质为 Fe 2 O 3 ,不能透过滤纸 D . 分散系为胶体,分散质粒子大小即 Fe(OH) 3 分子直径大小 |
|
| 4. | 详细信息 |
|
下列说法正确的是 A . C . NaClO 的电子式: |
|
| 5. | 详细信息 |
|
四氧化三铁 (Fe 3 O 4 ) 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备 Fe 3 O 4 纳米颗粒的反应是 A . 水热法制备 Fe 3 O 4 纳米颗粒的反应中,还原剂就是 B . 离子方程式中 x =4 C . 每生成 1 mol Fe 3 O 4 ,反应转移的电子为 4mol D . 该条件下 O 2 氧化性强于 |
|
| 6. | 详细信息 |
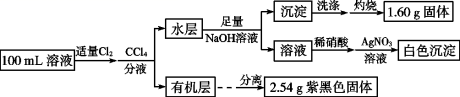
|
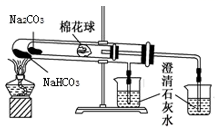
侯德榜 ( 如图 ) 是我国近代著名的化学家,他提出的联合制碱法得到世界各国的认可,其工业流程如图。下列说法错误的是 A . 该工艺流程中发生了复分解反应、分解反应,没有发生氧化还原反应 B . 应该向 “饱和食盐水”中先通入过量 CO 2 ,再通入 NH 3 C . 滤渣主要成分是 NaHCO 3 ,在相同温度下碳酸氢钠溶解度小于碳酸钠 D . 最终所得 “ 母液 ” 可循环利用 |
|
| 7. | 详细信息 |
|
下列物质的性质与用途具有对应关系的是 A . Al 2 O 3 的两性,铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物 B . NaHCO 3 受热易分解,可用小苏打治疗胃酸过多 C . Na 2 O 2 具有漂白性,可用作供氧剂 D . 抗坏血酸 ( 维生素 C) 具有氧化性,可用作水果罐头中的抗氧化剂 |
|
| 8. | 详细信息 |
|
庆祝中华人民共和国 70 周年的焰火晚会令人难忘,五颜六色火焰的产生与焰色试验有关。下述对焰色试验的叙述正确的是 ①钾的火焰颜色要透过蓝色钴玻璃观察②焰色试验是金属单质的特性 ③钡的焰色为绿色,钙元素的焰色为紫色④每次实验后,要将铂丝用硫酸洗净 ⑤没有铂丝时,也可以用光洁无锈的铁丝代替 ⑥所有金属或它们的化合物在火焰上灼烧时都会使火焰呈现出特征颜色 ⑦若火焰颜色为黄色,则一定含钠元素,不含钾元素 A . 仅有 ⑥⑦不正确 B . 仅有 ①③⑤正确 C . 仅有 ①⑤正确 D . 全正确 |
|
| 9. | 详细信息 | |||||||||||||||
|
下列实验操作、现象及结论正确的是
A . A B . B C . C D . D |
||||||||||||||||
| 10. | 详细信息 |
|
2018 年 11 月 13 日第 26 届国际计量大会对国际单位制进行修改。规定 1mol 任何粒子的粒子数叫做阿伏加德罗常数,符号为 N A 。若定义阿伏加德罗常数数值为 B ,下列有关说法正确的是 A . 实验室用 MnO 2 和浓盐酸制取氯气反应中,每生成 0.1B 个氯气,消耗还原剂为 0.4B B . 0.1B 个 Fe 加热时消耗 3.36L 氯气 C . 78gNa 2 O 2 中含有的阴离子数为 B D . 1L0.5mol/LHNO 3 溶液中含有的氧原子数为 1.5B |
|
| 11. | 详细信息 |
|
下列离子方程式正确的是 A . 过氧化钠做呼吸面具供氧剂: Na 2 O 2 +CO 2 =2Na + +CO B . 小苏打治疗胃酸过多: HCO C . 使用漂白粉时增强漂白能力向漂白粉溶液中加入少量白醋: ClO - +H + =HClO D . 检验补铁剂是否变质,溶解后加入 KSCN 溶液: Fe 3+ +3SCN - =Fe(SCN) 3 ↓ |
|
| 12. | 详细信息 |
|
下列有关一定物质的量浓度溶液的配制说法中正确的是 ①利用图 a 配制 0.10mol/LNaOH 溶液 ②为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至刻度线 ③利用图 b 配制一定浓度的 HCl 溶液浓度会偏小 ④利用图 c 配制一定物质的量浓度 Na 2 CO 3 溶液 ⑤配制 NaOH 溶液固体溶解后,直接转移至容量瓶,然后洗涤定容,所配溶液浓度偏高 ⑥用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体 A . ①⑥ B . ②⑤ C . ①④ D . ①⑤ |
|
| 13. | 详细信息 |
|
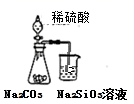
某工业废水中存在大量的 Na + 、 Cl - 、 Cu 2+ 、 SO 下列说法不正确的是 A . NaOH 的作用是除去 Cu 2+ B . 试剂 a 为 BaCl 2 ,试剂 b 为 Na 2 CO 3 C . 流程图中,操作 x 为过滤 D . 试剂 c 为硫酸 |
|
| 14. | 详细信息 |
|
类比和推理是化学研究的重要方法。下列说法正确的是 A . 卤素单质的熔点从 F 2 到 I 2 逐渐升高,则碱金属单质的熔点从 Li 到 Cs 逐渐升高 B . 117 号 Ts 的最低化合价为 -1 C . 铊 Tl 和铝同一主族,则铊的最高价氧化物对应的水化物 Tl(OH) 3 为两性 D . 周期表中碲在硫的下面,相对原子质量大,则碲化氢是比硫化氢更稳定的气体 |
|
| 15. | 详细信息 |
|
门捷列夫在研究元素周期表时,科学地预言了 11 种当时尚未发现的元素,为它们在周期表中留下空位 ( 如图 ) ,结合现代周期表和化学的发展和认知,下列说法正确的是 A . ①所代表的元素位于Ⅲ族,第四周期 B . ②所代表的元素既能表现一定的金属性,又能表现一定的非金属性 C . ①②所代表的的元素的金属性:①<② D . 表中同一纵行的元素就是现在使用的长周期表的同一周期元素 |
|
| 16. | 详细信息 |
|
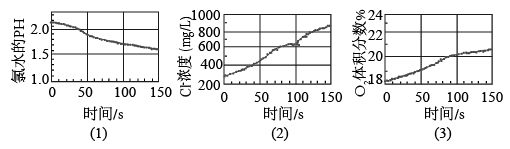
数字化实验将传感器、数据采集器和计算机一起相连,采集实验过程中各种物理量变化的数据并记录和呈现,如图采集的用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如图曲线。下列说法不正确的是 A . 强光照射下,氯水中反应生成了酸性更强的酸 B . 强光照射下,氯水中 ClO - 转化为 Cl - C . 强光照射下,氯水中有氧气生成 D . 溶液中发生了的反应离子方程式有 2ClO - |
|
| 17. | 详细信息 |
|
常温下, c(H + )=0.1mol/L 的某溶液中可能含有 Na + 、 Fe 3+ 、 Fe 2+ 、 I - 、 Cl - 、 CO 已知氧化性 Fe 3+ >I 2 。根据实验结果,判断下列说法正确的是 A . Fe 3+ 与 Fe 2+ 至少有一种 B . 一定不存在 CO C . 一定存在 Fe 2+ 、 I - 、 Cl - D . 该溶液中一定存在 Fe 2+ 、 I - ,可能含 Cl - |
|
| 18. | 详细信息 |
|
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解。下列表达正确的是 A . Na 2 CO 3 溶液和盐酸反应后溶液中的钠盐 B . NaOH 溶液与 CO 2 反应后溶液中的钠盐 C . 常温下钠与氧气的反应生成的氧化物 D . AlCl 3 溶液中滴加氨水后铝元素的存在形式 |
|
| 19. | 详细信息 | ||||||||||||
|
下列图示实验合理的是
A . A B . B C . C D . D |
|||||||||||||
| 20. | 详细信息 |
|
A 、 B 、 C 、 D 、 E 的原子序数依次增大, A 原子是主族元素中原子半径最小的, B 原子的最外层电子数等于其次外层电子数 3 倍, C 元素是地壳中含量最高的金属元素, D 的最高价氧化物对应水化物的化学式为 H n DO 2n+2 , E 有两种常见简单离子,低价离子为绿色。下列说法错误的是 A . E 为过渡元素 B . A 与 B 形成的某化合物含非极性键 C . 简单离子半径: A < B < C < D D . C 与 D 的最高价氧化物的水化物之间可以反应 |
|
| 21. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
1869 年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。元素周期表与元素周期律在化学学习研究中有很重要的作用。 (1) 下表是元素周期表的一部分
i .元素 ④ 的过氧化物的电子式为 ______ ,其最高价氧化物对应的水化物含有的化学键类型为 ______ , ⑩ 元素最高价氧化物对应的水化物的化学式是 ______ 。 ii .元素 ①、②、③的简单氢化物的稳定性最强的是 ______ ( 用化学式表示,下同 ) , ②、⑧简单氢化物熔点高的是 ______ , ④、⑤最高价氧化物的水化物碱性更强的是 ______ , ④、⑤、⑧、⑨的简单离子半径由大到小的顺序 ______ 。 (2) 最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是 37 号元素,相对原子质量是 85 。 i .铷在元素周期表中的位置 ______ 。 ii .关于铷的下列说法中不正确的是 ______ ( 填序号 ) 。 a. 与水反应比钠更剧烈 b.Rb 2 O 在空气中易吸收水和二氧化碳 c.Rb 2 O 2 与水能剧烈反应并释放出 O 2 d. 单质具有很强的氧化性 e.RbOH 的碱性比同浓度的 NaOH 弱 |
|||||||||||||||||||||||||||||||||||||
| 22. | 详细信息 | ||||||||||||||||||||||||||||||||||||||
|
钙是人体中不可缺少的营养元素。钙元素对于骨骼的形成,心脏的跳动,人体的发育,消除疲劳,健脑益智,延缓衰老等都发挥着重要的作用。医学上常将酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量,反应为 6H + +2MnO
(1) 标明上述反应电子的转移方向和数目: ______ 。 (2) 该反应中氧化剂和氧化产物的物质的量之比是 ______ 。 (3) 测定血钙的含量的方法是:取 2mL 血液用蒸馏水稀释为 20mL 后,向其中加入足量 (NH 4 ) 2 C 2 O 4 溶液,反应生成 CaC 2 O 4 沉淀,将沉淀用稀硫酸溶解得到 H 2 C 2 O 4 后,再用 KMnO 4 溶液滴定至恰好完全反应。 ①溶解沉淀时 __ ( 能或不能 ) 用稀盐酸,原因是 __ 。 ②若滴定所用的 KMnO 4 溶液为 1.0×10 -4 mol/L ,则该血样消耗高锰酸钾溶液 ______ mL 。 |
|||||||||||||||||||||||||||||||||||||||
| 23. | 详细信息 | |||||||||
|
2020 年突如其来的 “ 新冠肺炎 ” 使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是 “ 84 ”消毒液,可以说化学让生活更美好。图为“ 84 ”消毒液说明书。请回答下列问题。
(1) “ 84 ”消毒液的有效氯指的是每升含氯消毒剂的氧化能力 ( 得失电子数 ) 相当于多少克 Cl 2 的氧化能力 (Cl 均转化为 Cl - ) 。若该 “ 84 ”消毒液商品的有效氯按 53.25g/L 计算,该消毒液的 NaClO 的物质的量浓度是 _______ 。 (2) 常温下用烧碱溶液吸收 Cl 2 制备 “ 84 ”消毒液。写出该反应的离子方程式 _______ ,若将 Cl 2 通入热的烧碱溶液中,可以得到 NaCl 、 NaClO 和 NaClO 3 的混合液。当混合液中 Cl - 和 ClO (3) 家庭用 “ 84 ”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是 ______ ( 用离子方程式表达 ) 。 ( 已知:酸性: H 2 CO 3 >HClO>HCO (4) 游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会 _______ ( 填 “ 增强 ” 或 “ 减弱 ”) 。 (5)Cl 2 可直接用于杀菌消毒,但常常把氯气制成漂白粉、 “ 84 ”消毒液,主要目的 _____ 。 A .增强漂白能力和消毒作用 B .使它转化为较稳定物质,便于保存和运输 C .使它转化为较易溶于水的物质 D .提高氯的质量分数,有利于漂白、消毒 |
||||||||||
| 24. | 详细信息 | |||||||||||||||||||||
|
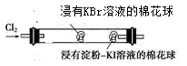
铁常见的化合价有 0 、 +2 、 +3 ,某化学兴趣小组进行了一系列有关铁及其化合物的实验,并检验其中所含的铁元素的化合价。 (1) 利用如图装置进行 “ 铁与水反应 ” 的实验,并检验产物。 ① D 仪器名称 ______ 。 B 中反应的化学方程式为 ______ 。 ② E 中的 ______ 现象是可以证明反应后生成 H 2 。 ③点燃 E 处酒精灯之前应进行的操作是 ______ 。 ④
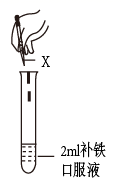
现象 A 是 ______ , a 溶液中不含 Fe 3+ 的原因 ______ 。 (2) 铁是人体必需的微量元素。某种补铁口服液 ( 标签如图 ) 。根据名称猜测该糖浆中含有 Fe 2+ ,设计方案进行验证。设计方案如图:
发现有些实际现象与预期现象不同,原因是什么呢?药品说明书如下: ①结合资料对实验 iii 实际现象与预期现象不同的原因进行猜想: ______ ;为验证该猜想,在方案 ⅲ的基础上继续加入过量的新制氯水,得到了预期现象。 ②实验反思:方案ⅱ中实验现象 ______ ( 填 “ 能 ” 或 “ 不能 ”) 证明补铁口服液中一定含有 Fe 2+ ,理由是 ______ 。 |
||||||||||||||||||||||