2019河南高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
化学与生产、生活、科技、环境等密切相关。下列说法正确的是 A.“华为麒麟980”手机中芯片的主要成分是二氧化硅 B. “一带一路”是现代丝绸之路,丝绸的主要成分是蛋白质,属于天然高分子化合物 C. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应 D. 纯碱既可用于清洗油污,也可用于治疗胃酸过多
|
|
| 2. | 详细信息 |
|
下列化学用语表述正确的是 A. 乙烯的结构简式:CH2CH2 B. 乙醇的分子式:CH3CH2OH C. 甲醛的结构式:
|
|
| 3. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是 A.无色透明的溶液中:Fe3+、NH4+、I—、CO32- B.c(Al3+)=0.1mol/L的溶液中:K+、Mg2+、SO42-、AlO2- C.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、NO3- D.c(H+)/c(OH-)=1×10l2的溶液中: Ca2+、Na+、SiO32-、HCO3-
|
|
| 4. | 详细信息 |
|
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr A.加入NaOH,可增大乙醇的物质的量 B.增大HBr浓度,有利于生成C2H5Br C.若反应物均增大至2 mol,则两种反应物平衡转化率之比不变 D.若起始温度提高至60℃,可缩短反应达到平衡的时间
|
|
| 5. | 详细信息 |
|
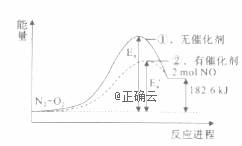
在其他条件相同时,反应N2+O2=2NO分别在有、无催化剂时的能量变化如下图所示,下列说法中不正确的是
A. 该反应中反应物的总能量比生成物的总能量低 B. 0.2 mol NO完全分解成N2和O2时共放出热量18.26 kJ C. 加入催化剂可以改变反应的活化能 D. 加入催化剂能改变反应的焓变
|
|
| 6. | 详细信息 |
|
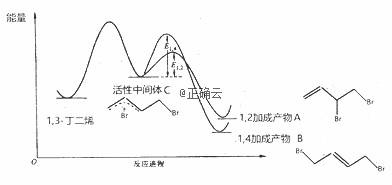
当1,3-丁二烯和溴单质1:1加成时,其反应机理及能量变化如下:
不同反应条件下,经过相同时间测得生成物组成如下表:
下列分析不合理的是 A.产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争 B.相同条件下由活性中间体C生成产物A的速率更快 C.实验1测定产物组成时,体系己达平衡状态 D.实验1在t min时,若升高温度至25℃,部分产物A会经活性中间体C转化成 产物B
|
|
| 7. | 详细信息 | |||
|
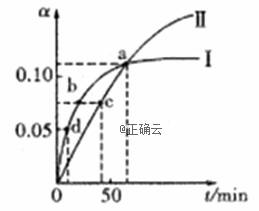
已知:2CH3COCH3(1) CH3COCH2COH(CH3)2(1)。取等量CH3COCH3分别在 0℃和20℃下反应,测得其转化率(α)随时间(t)变化的关系曲线如右图所示。下列说法正确的是 A.化学反应速率的大小顺序为:d>b>c B.升高温度能提高反应物的平衡转化率 C.在a点时,曲线Ⅰ和Ⅱ表示反应的化学平衡常数相等 D.曲线Ⅱ表示20℃时的转化反应
|
||||
| 8. | 详细信息 |
|
A.麦芽糖在人体内的水解产物能和银氨溶液发生反应 B.淀粉、纤维素、蛋白质和油脂都是有机高分子化合物 C.在鸡蛋清溶液中加入饱和的Na2SO4溶液时,会使蛋白质析出 D.在一定条件下氨基酸之间能发生反应,合成更复杂的化合物(多肽),构成蛋白质
|
|
| 9. | 详细信息 |
|
下列关于有机化合物的说法正确的是 A.HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C.除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯 D.用酸性高锰酸钾溶液鉴别苯甲醇、乙醇和苯甲醛
|
|
| 10. | 详细信息 |
|
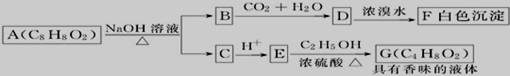
药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。则下列说法正确的是
A.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚 B.上述各物质中能发生水解反应的有A、B、D、G C.G的同分异构体中属于酯且能发生银镜反应的有2种 D.1molA最多能与lmolNaOH反应
|
|
| 11. | 详细信息 | ||||||||||||||||||||
|
下列实验操作及对应的现象与结论都正确的是
|
|||||||||||||||||||||
| 12. | 详细信息 |
|
下列说法错误的是 A. 弱酸pH=a,加水稀释到10n倍,则pH<a+n (a+n<7) B. 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量不相同,醋酸消耗NaOH的物质的量多 C. 0.1 mol·L-1NaHCO3溶液中粒子浓度关系:c(Na+)=2c(CO32¯)+c(HCO3¯)+c(H2CO3) D. 常温下,pH=2的盐酸、pH=2的醋酸中由水电离出的c(H+)=c(OH-)=10-12 mol·L-1
|
|
| 13. | 详细信息 | |||
|
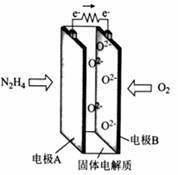
一种以肼(N2H4)为燃料的新型环保电池的工作原理如图所示。下列说法正确的是 A. 电极A的电势比电极B的低 B. 电极A的电极反应式为N2H4-4e-+4OH-===N2+4H2O C. 电极B发生氧化反应 D. 每消耗11.2L的O2,转移的电子数为2NA
|
||||
| 14. | 详细信息 |
|
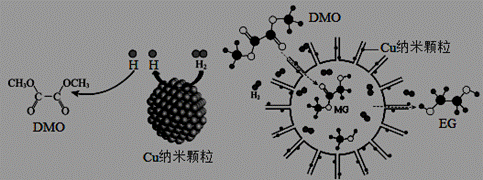
我国学者研制了一种纳米反应器,用于催化草酸二甲酯 (DMO)和氢气反应获得EG。反应过程示意图如下: 下列说法不正确的是 A.Cu纳米颗粒将氢气解离成氢原子 B.DMO分子中只有碳氧单键发生了断裂 C.反应过程中生成了MG和甲醇 D.EG和甲醇不是同系物 |
|
| 15. | 详细信息 |
|
室温下,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010,下列有关说法中正确的是 A.溶液的pH=4 B.加蒸馏水稀释后,c(HA)/c(A-)减小 C.向体积和pH均相等的HA溶液与盐酸中加入足量锌,盐酸中产生的气体多 D.在NaA溶液中存在浓度关系:c(H+)>c(OH-)
|
|
| 16. | 详细信息 | |||
|
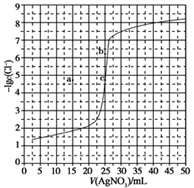
用0.100 mol·L-1 AgNO3溶液滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是 A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点 c移到a D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点 c向b方向移
|
||||
| 17. | 详细信息 |
|
某化学课外小组实验室制取乙酸乙酯时查阅资料如下:
根据查得的资料设计了下图所示的装置(夹持装置忽略)制取纯净的乙酸乙酯。
步骤如下: ①在图1的三口烧瓶中加入3mL乙醇,边摇动边慢慢加入3mL浓硫酸,在分液漏斗中装入3:2的乙醇和乙酸混合液。 ②油浴加热三口烧瓶至一定温度,然后把分液漏斗中的混合液慢慢地滴入三口烧瓶里并保持反应混合物在一定温度。 ③反应一段时间后,向锥形瓶中缓慢加入饱和Na2CO3溶液,并不断摇动,分层后进行分液。 ④用饱和食盐水和氯化钙溶液洗涤酯层,再分液,在酯层加入干燥剂干燥得粗乙酸乙酯。 ⑤将粗乙酸乙酯转入图2的仪器A中,在水浴中加热,收集74~80℃的馏分即得纯净的水果香味无色透明液体。 根据题目要求回答: (1)在实验中浓硫酸的作用__________________; (2)歩骤②中油浴加热保持120-125℃温度范围 ,如果温度在170℃,则发生一个副反应,请写出该反应的化学方程式__________________ (3)图2中仪器A的名称是__________________,冷凝管中冷水从______(填a或b)口进入。 (4)步骤③和④中都用到了分液操作,该操作用到的主要玻璃仪器是_________ ,在分液操作时,上下两层液体移出的方法是____________。 (5)步骤④中干燥乙酸乙酯,可选用的干燥剂为______(填字母)。 a.五氧化二磷 b.无水Na2SO4 c.碱石灰
|
|
| 18. | 详细信息 |
|
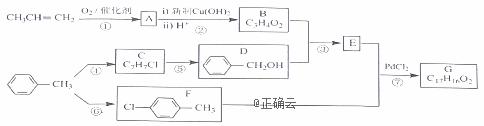
有机物G是一种香料,可采用丙烯和甲苯为主要原料按下列路线合成: (1)A的分子式为___________,F的名称是__________ (2)B中含有的官能团名称为 __________________ (3)③的反应类型为_____________,反应⑤的试剂及条件为___________ (4)反应 ⑦的化学方程式为____________________________________ (5)X比D多1个CH2原子团,X的同分异构体中,能与FeCl3溶液发生显色反应的有______种,写出一种属于D的同系物且能发生消去反应的X的结构简式:______
|
|
| 19. | 详细信息 |
|
研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题: (1)科学家提出可利用FeO吸收和利用CO2,其原理为: 已知:C(s)+2H2O(g)====CO2(g)+2H2(g) △H=+113.4kJ·mol-1 3FeO(s)+H2O(g)====Fe3 O4(s)+H2(g) △H=+18. 7 kJ·mol-1 则反应6FeO(s)+CO2(g)====2Fe3O4(s)+C(s)的△H=__________________。 (2)肼的制备方法是用次氯酸钠氧化过量的氨。 已知ClO-水解的方程式为:ClO-+H2O (3)工业上利用氨气生产氢氰酸(HCN)的反应为: CH4(g)+NH3(g) ①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图1所示。X代表的是________(填“温度”或“压强”)。
②其他条件一定,向2L密闭容器中加入n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图2所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________;该温度下,b点的平衡常数为____________ (4)纳米氧化亚铜Cu2O是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。电解过程中无气体产生,则铜棒作________极,阴极生成Cu2O的电极反应式为______________________,
|
|