2018北京高三下学期人教版高中化学月考试卷
| 1. | 详细信息 | |||||||||||||||
|
下列实验操作、现象、解释和所得到的结论都正确的是
A.A B.B C.C D.D
|
||||||||||||||||
| 2. | 详细信息 |
|
我国有着悠久的“玉文化”,古代精美绝伦的玉器,其工艺之精湛,至今为人们所叹服。据研究,古代是以精选的河砂作为磨料对玉石进行加工的。唐代诗人白居易留下了“试玉要烧三日满,辨材须待七年期”的名句。下列有关“玉”的说法正确的是 A.玉的主要成分是氧化铝 B.玉的硬度比河砂的大 C.玉的熔点较高 D.玉是金刚砂
|
|
| 3. | 详细信息 |
|
对下列化学用语的理解和描述均正确的是 A.离子方程式H++OH-===H2O可表示所有强酸与强碱溶液的反应 B.原子结构示意图 C.比例模型 D.电子式
|
|
| 4. | 详细信息 |
|
下列关于反应4Li+2SOCl2=4LiCl+S+SO2↑的叙述中,正确的是 A.SOCl2既是氧化剂又是还原剂,Li是还原剂 B.若2mol SOCl2参加反应,则转移的电子数为8NA(NA表示阿伏加德罗常数的值) C.若将该反应设计成电池,则SOCl2在正极发生反应 D.若将该反应设计成电池,则可用稀硫酸作电解质溶液
|
|
| 5. | 详细信息 |
|
化学与人类生产、生活、社会可持续发展密切相关。下列说法不正确的是 A.将“地沟油”制成“生物柴油”作为内燃机燃料的做法符合“绿色化学”的理念 B.“青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 C.酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
|
|
| 6. | 详细信息 |
|
萜类化合物广泛存在于动植物体内,下列关于萜类化合物的说法中正确的是
A.a和b都属于芳香族化合物 B.a和c分子中所有碳原子均处于同一平面上 C.b能与NaOH溶液反应 D.a、b、c均能发生加成反应
|
|
| 7. | 详细信息 |
|
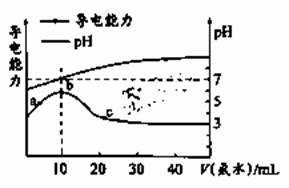
常温下,向10mL0.1mol/L的某酸(HA) 溶液中逐滴加入0.1mol/L的氨水,所得溶液的pH及导电能力与加入氨水的体积关系如图所示。下列说法中不正确的是
A.HA为弱酸 B.b点对应溶液pH=7,此时HA溶液与氨水恰好完全反应 C.c点对应的溶液存在c(OH-)=c(H+)+c(HA) D.a、b、c三点中,b点对应的溶液中水的电离程度最大
|
|
| 8. | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 A.c(H+)/c(OH-)=l010的溶液中: K+、Fe2+、Cl-、SO42- B.含有大量Al3+的溶液中: Na+、NH4+、CO32-、Cl- C.某无色溶液中: Na+、HCO3-、Cu2+、SO42- D.水电离出来的c(H+) =10-13mol/L的溶液中: NH4+、K+、NO3-、SiO32-
|
|
| 9. | 详细信息 |
|
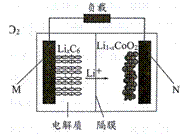
菲斯科(FiskerInc.)公司宣布正在开发的固态锂电池能量密度是现有电池的2.5倍,续航里程可达500英里(约804公里),最快充电时间可以分钟计,钴酸锂(LiCoO2) 电池的工作原理如图所示,M极材料是金属锂和碳的复合材料(碳作金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过。下列说法正确的是
A.电池的总反应式为:LixC6+Li1-xCoO2==C6+LiCoO2 B.M为电池的正极 C.放电时,N为负极,电极发生氧化反应 D.充电时,M为阳极,电极发生氧化反应
|
|
| 10. | 详细信息 |
|
下列说法不正确的是 A.化学键的断裂和形成是化学反应中能量变化的主要原因 B.已知常温下Ksp[Mg(OH)2]=1.8×10-11,则Mg(OH)2在pH=12NaOH溶液中的溶解度约为1.044×10-6g C.水能,风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 D.用酚醛树脂制成的塑料可反复加热熔融加工
|
|
| 11. | 详细信息 |
|
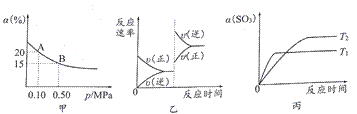
已知反应: 2SO3(g)
①由图甲推断,B点SO2的平衡浓度为03mol/L ②由图甲推断,A点对应温度下的平衡常数为1.25×10-3 ③达平衡后,压缩容器容积,则反应速率变化图像可以用图乙表示 ④相同压强、不同温度下SO3的转化率与温度关系如丙图所示 A.①② B.②③ C.③④ D.①④
|
|
| 12. | 详细信息 |
|
四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是 A.W的氢化物分子之间都能形成氢键 B.气态氢化物的稳定性Y>Z C.W、X、Y三种元素组成的化合物的水溶液一定呈中性 D.W与X形成的化合物中只存在离子键
|
|
| 13. | 详细信息 |
|
室温下,向下列溶液中通入相应的气体至溶液pH=7 (通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系确的是 A.向0.10mol/L NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) B.向0.10 mol/L NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+) C.向0.10 mol/L Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] D.向0.10 mol/L CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)>c(Cl-)
|
|
| 14. | 详细信息 |
|
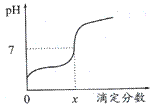
常温下,用0.1mol/L的NaOH溶液滴定相同浓度的一元弱酸HA20mL,滴定过程中溶液的pH随滴定分数(滴定分数=
A.HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减少 B.当滴定分数为1时,溶液中水的电离程度最大 C.当滴定分数大于1时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)> c(H+) D.当滴定分数为x时,HA的电离常数为KHA=(10-7x)/(1-x)
|
|
| 15. | 详细信息 |
|
“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。 (1)请写出金属钒与浓硝酸反应的离子方程式:__________________________________, (2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:___________。 (3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:______________________________________。 (4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:______、______。 (5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450℃时发生V2O5与VO2之间的转化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是_________。
|
|
| 16. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
碳和氮的化合物在生产生活中广泛存在。回答下列问题: (1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学力程式为______________。 (2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。 (3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)
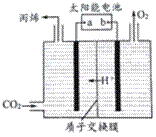
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。 ②该反应的△H______0(填“>”或“<”)。 ③丙容器达到平衡时,CO的转化率为____________________________。 (4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O (5)如图是在酸性电解质溶液中,以情性材料作电极,将CO2转化为丙烯的原理模型。
①太阳能电池的负极是_________。(填“a”或“b”) ②生成丙烯的电极反应式是____________________________。
|
|||||||||||||||||||||||||||||||||||||
| 17. | 详细信息 |
|
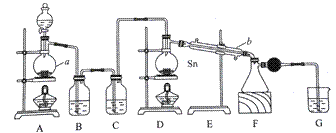
四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。分液漏斗中放浓盐酸,仪器a中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
(1)仪器a、b的名称分别是______、________,仪器b的作用是__________________。 (2)图中装置F与装置G之间连接干燥管的目的是______________________________。 (3)装置D中Sn发生反应的化学方程式为___________;装 置 G 的作用是____________。 (4)装置B中的试剂是______________________;装置C的作用是_________________。 (5)实验过程中。当观察到________时,即可熄灭装置D处的酒精灯。 (6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,请写出四氯化锡水解的化学方程式______________________________________。
|
|
| 18. | 详细信息 |
|
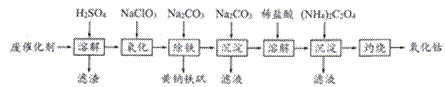
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下。
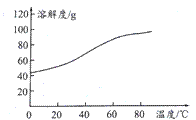
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是__________________。 (2)氧化:加热搅拌条件下加入NaC1O3,其作用是_______________________________。 (3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾Na2[Fe6(SO4)4(OH)12]沉淀。写出该反应的化学方程式:__________________________________________________。 (4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,检验沉淀是否洗涤干净的操作是_________________________________________________________。 (5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是__________________________________。
(6)灼烧:准确称取所得CoC2O4固体2.205g,在空气中灼烧得到钴的一种氧化物1.205g,写出该氧化物的化学式_________________________。
|
|
| 19. | 详细信息 |
|
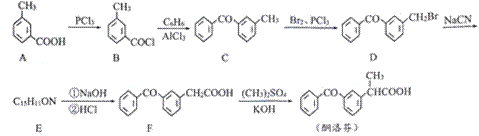
.酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
(1)化合物D中所含官能团的名称为__________________和_____________________。 (2)化合物E的结构简式为__________________;由B→C的反应类型是____________。 (3)写出C→D的反应方程式____________________________________。 (4)B的同分异构体有多种,其中同时满足下列条件的有_____种。 I.属于芳香族化合物 II.能发生银镜反应 III.其核磁共振氢谱有5组波峰,且面积比为1:1:1:1:3 (5)请写出以甲苯为原料制备化合物
|
|