2020重庆高一上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是 A.
|
|
| 2. | 详细信息 |
|
下列仪器中可直接加热的是 A. 圆底烧瓶 B. 蒸发皿 C. 量筒 D. 容量瓶
|
|
| 3. | 详细信息 | |||||||||||||||||||||||||
|
下列各组物质分类正确的是
|
||||||||||||||||||||||||||
| 4. | 详细信息 |
|
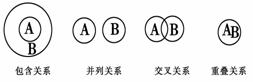
化学概念在逻辑上存在如下关系,对下列概念的说法正确的是
B. 氧化还原反应与化合反应属于包含关系 C.溶液与分散系属于并列关系 D.氧化物与碱性氧化物属于交叉关系
|
|
| 5. | 详细信息 |
|
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是 A.浓硫酸的质量增重 B.澄清的石灰水变浑浊 C.氢氧化钠的表面发生潮解 D.钠的表面变暗
|
|
| 6. | 详细信息 |
|
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指 A. 萃取 B. 渗析 C. 蒸馏 D. 升华
|
|
| 7. | 详细信息 |
|
下列有关物质鉴别与除杂的方法描述错误的是 A.用稀盐酸除去铜粉中混有少量铁粉 B.只用一种试剂可以鉴别CuO粉末、炭粉、铁粉三种黑色粉末 C.用滤纸过滤除去溶液中的胶体粒子 D.用水可以鉴别四氯化碳和苯两种无色液体
|
|
| 8. | 详细信息 |
|
下列关于胶体的说法不正确的是 A.直径为1.3×10-9 m 的“钴酞菁”分子分散在水中能形成胶体,则该分子的直径比Na+大 B.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 C.“血液透析”涉及到胶体性质的应用 D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
|
|
| 9. | 详细信息 | |||||||||||||||
|
利用实验器材(规格和数量不限)能完成相应实验的一项是
|
||||||||||||||||
| 10. | 详细信息 |
|
在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是 A. 量取浓盐酸时仰视刻度线 B. 定容时仰视容量瓶刻度线 C. 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 D. 定容摇匀时发现液面降低,又补加少量水重新达到刻度线
|
|
| 11. | 详细信息 |
|
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是 ①向石灰水中逐渐通入CO2直至过量 ②向CaCl2溶液中逐渐通入CO2直至过量 ③向Ba(OH)2溶液中逐滴加入稀硫酸直至过量 ④向Fe(OH)3胶体中逐滴加入稀盐酸直至过量 A. ①② B. ①③ C. ①④ D. ②④
|
|
| 12. | 详细信息 |
|
.下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是 A. Na与O2 B. Na2O2与CO2 C. C与O2 D. NaOH与CO2
|
|
| 13. | 详细信息 |
|
设NA 表示阿伏加德罗常数的值,下列说法正确的是 A. 常温下100 mL 0.1mol/L醋酸溶液中含醋酸分子0.01NA B. 1 mol Na与足量O2反应生成Na2O和Na2O2的混合物共失去NA个电子 C. 已知NaCl溶于乙醇中可制成胶体,0.1 mol NaCl在乙醇中形成的胶体含有0.1 NA个胶粒 D. 7.8 g Na2O2的固体混合物中含有的阴离子数0.2NA
|
|
| 14. | 详细信息 | |
|
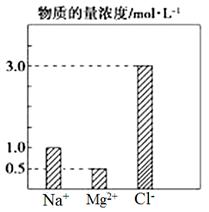
下图是某品牌饮用矿泉水的标签的部分内容。下列说法正确的是
A.标签上的离子的浓度是物质的量浓度 B.取少量待测液加入稀盐酸酸化,再滴入硝酸银,出现白色沉淀,说明有氯离子 C.该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4 mol/L D.一瓶该品牌饮用矿泉水中 SO42-的物质的量不超过1×10-5 mol
|
||
| 15. | 详细信息 |
|
实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.1 mol·L-1,下面四个选项中能达到此目的的是 A.Fe2+、Na+、NO C.H+、K+、Cl-、CH3COO- D.Mg2+、NH
|
|
| 16. | 详细信息 |
|
下列离子方程式的书写正确的是 A. 澄清石灰水与过量碳酸氢钠溶液反应:Ca2+ + 2OH- + 2HCO3- == CaCO3↓+ 2H2O + CO B. 向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-恰好完成沉淀:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O C. 钠与CuSO4溶液反应的离子方程式:2Na + Cu2+ =Cu↓+ 2Na+ D. 向石灰乳中加入盐酸:OH﹣+H+=H2O
|
|
| 17. | 详细信息 |
|
相等物质的量的KClO3分别发生下述反应: ①有MnO2催化剂存在时,受热完全分解得到氧气; ②若不使用催化剂,加热至470℃左右充分反应,得到KClO4(高氯酸钾)和KCl。 下列关于①和②的说法不正确的是 A. 都属于氧化还原反应 B. 发生还原反应的元素相同 C. 发生氧化反应的元素不同 D. 生成KCl的质量相同
|
|
| 18. | 详细信息 |
|
已知X2、Y2、Z2、W2四种单质,已知它们能发生如下反应: ①X2+2NaY=Y2+2NaX ②Z2+2NaX=X2+2NaZ ③W2+2NaZ=Z2+2NaW 下列说法中不正确的是 A.Z2与Y﹣在水溶液中不能大量共存 B.还原性:Y﹣>Z﹣>W﹣ C.2NaW+Y2=2NaY+W2 D.W2通入到NaX和NaY的混合溶液中:W2优先氧化Y﹣
|
|
| 19. | 详细信息 |
|
如右下图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是 A.甲、乙、丙都属于氧化还原反应 B.甲充分反应,产生气体体积约为1.12 L C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol D.丙反应中的氧化剂是Na2O2,还原剂时H2O
|
|
| 20. | 详细信息 |
|
20 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的NaXO4溶液完全反应。溶液中XO4-被还原为较低价态,则X元素的化合价变为 A.+1 B.+2 C.+3 D.+4
|
|
| 21. | 详细信息 |
|
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8 mol N2,右边充入CO和CO2的混合气体共64 g时,隔板处于如图位置(保持温度不变),下列说法正确的是 A.右边CO与CO2分子数之比为1:3 B.右侧CO的质量为14 g C.右侧气体密度是相同条件下氧气密度的2倍 D.若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为5:6
|
|
| 22. | 详细信息 |
|
(原创)化学方程式、电离方程式、离子方程式都是非常重要的化学用语。 (1)常温常压下,现有下列十种物质:①Al ②NaHSO4 ③乙醇 ④CO2 ⑤醋酸 ⑥小苏打 ⑦Fe(OH)3 ⑧NaOH ⑨氨水 ⑩(NH4)2SO4 上述状态下可导电的物质是 (填编号,下同);属于非电解质的是 ;属于弱电解质的是____________;⑤在水中的电离方程式为 。 (2)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为 。 (3)过氧化钠可作为呼吸面具和潜水艇中的供氧剂,写出过氧化钠与二氧化碳反应的化学方程式 。 (4)请写出实验室制备Fe(OH)3胶体的离子方程式 。 (5)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4 + 2CH3COONH4 = (CH3COO)2Pb + (NH4)2SO4。现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
|
|
| 23. | 详细信息 |
|
(原创)按要求填空 (1)H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3为__________元酸,Na2HPO3为 (填“正盐”或“酸式盐”)。 (2)酸性条件下,次磷酸(H3PO2)可发生下列反应而用于化学镀银.
试回答下列问题: ①该反应的氧化产物是 。 ②请将反应物和生成物补充完整并配平,并用单线桥法标出电子转移的数目。 ③若反应中生成10.8 g Ag,则转移电子的数目约为 。 (3)在同温、同压下,实验测得CO2和O2两种气体的混合气体的密度是H2的20倍,则该混合气体的平均摩尔质量为___________,其中O2的体积分数为 (保留3位有效数字)。 (4)常温常压下,将0.2 mol钠、镁分别放入到100 mL 1 mol/L的盐酸中,产生氢气的体积比为 。
|
|
| 24. | 详细信息 |
|
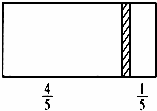
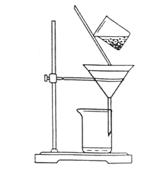
(1)加入A试剂,是为了除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42﹣离子。A代表的是多种试剂,按滴加顺序依次为:i NaOH,ii ,iii (填化学式)。 (2)请写出下列试剂加入试剂i时发生主要反应的离子反应方程式: 。 (3)右下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
b.玻璃棒用作引流 c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗 e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (4)操作Ⅲ的名称是 。 (5)m g粗盐提纯后得到n g纯净的NaCl固体,则m与n的大小关系为 . A.m>n B.m<n C.m=n D.无法确定.
①配制需要的玻璃仪器有玻璃棒、量筒、烧杯、 (填仪器名称) ②需量取浓盐酸的体积为: mL。(结果保留1位小数)
|
|
| 25. | 详细信息 |
|
步骤一:仔细观察,该溶液呈无色、透明、均一状态。 步骤二:加入足量BaCl2溶液,生成23.3 g白色沉淀,再加稀硝酸,沉淀不消失。 (1)原溶液中除上图中的离子以外,肯定还含有的离子是 ,肯定不含有的离子是 。 (2)实验操作的步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、 。检验沉淀已洗干净的方法是 。 (3)原溶液中H+物质的量浓度为 mol/L。 (4) 向原溶液中加入NaHCO3溶液,反应的离子方程式为: 。 (5)若向100 mL原溶液中加入1 mol/L的Ba(OH)2溶液,当生成的沉淀质量刚好最大时,则加入的Ba(OH)2溶液体积为 L。
|
|
| 26. | 详细信息 |
|
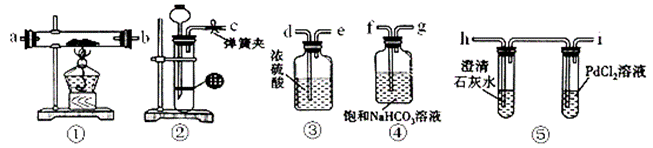
已知2Mg+CO2
(1)原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等。 (2)装置②中用稀盐酸与CaCO3反应制备CO2,制备该气体时发生反应的离子方程式是 。 (3)请将图中各装置按顺序连接(填装置接口字母):c接______,______接____,____接______,____接 。 (4)装置③的作用是 。 (5)检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。此步操作的目的是 。 (6)根据下列实验现象,推测并请写出钠与CO2反应的化学方程式。 I. 实验过程中若观察到装置⑤PdCl2溶液中有黑色沉淀,且装置①中固体成分只有一种,向固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体。请写出钠与CO2反应的化学方程式 。 II. 若实验开始前装置①中钠的质量为0.46 g,实验结束后,将装置①中的固体加入到装有足量的稀盐酸的烧杯中,充分反应产生224 mL(标准状况)CO2气体,反应后烧杯中还残留有黑色固体。请写出钠与CO2反应的化学方程式 。
|
|
 B.
B. C.
C.  D.
D.