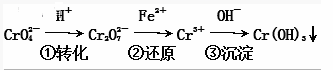2020四川高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
化学与人类生活、社会可持续发展密切相关,保护环境问题已经广泛引起人们关注,下列说法不利于环境保护的是 A.加快化石燃料的开采与使用 B.推广使用节能环保材料
|
|
| 2. | 详细信息 |
|
下列物质的水溶液在空气中小心加热蒸干,能得到较纯净的原溶质的是 A.CuSO4 B.FeSO4 C.NaHCO3 D.FeCl3
|
|
| 3. | 详细信息 |
|
已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH A.加少量烧碱溶液 B.降低温度 C.加少量冰醋酸 D.加水
|
|
| 4. | 详细信息 |
|
通过以下反应均可获取 ①太阳光催化分解水制氢: ②焦炭与水反应制氢: ③甲烷与水反应制氢: A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂, D.反应
|
|
| 5. | 详细信息 |
|
下列说法正确的是 A.常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定等于7
|
|
| 6. | 详细信息 |
|
室温时,0.1mol·L-1的HA溶液的pH=3,向该溶液中逐滴加入NaOH溶液,在滴加过程中,有关叙述正确的是 A.原HA溶液中,c(H+)=c(OH-)+c(A-) B.当滴入少量的NaOH溶液时,促进了HA的电离,溶液的pH降低
|
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是 A.向NaHSO4溶液中加入Ba(OH)2溶液至恰好显中性:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O
|
|
| 8. | 详细信息 |
|
对可逆反应4NH3(g)+5O2(g) A.达到化学平衡时4v正(O2)=5v逆(NO)
|
|
| 9. | 详细信息 |
|
已知 A.浓度均为0.1
|
|
| 10. | 详细信息 |
|
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O和CrO,常用的方法为还原沉淀法该法的工艺流程为 其中第①步存在平衡2CrO(黄色)+2H+ (1)写出第①步反应的平衡常数表达式__________ (2)关于第①步反应,下列说法正确的是__________ A.通过测定溶液的pH是否变化可以判断反应是否已达平衡状态 B.该反应为氧化还原反应 C.强酸性环境,溶液的颜色为橙色 (3)第②步中,还原0.1mol Cr2O,需要__________mol的FeSO4·7H2O。 (4)第③步除生成Cr(OH)3外,还可能生成的沉淀为__________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
|
|
| 11. | 详细信息 |
|
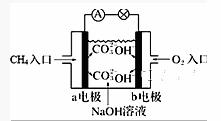
电化学应用广泛。请回答下列问题: (1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为__________;正极的电极反应式为__________ (2)燃料电池和二次电池的应用非常广泛。 ①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为__________;负极的电极反应式为__________;
②铅蓄电池为生活中常用的二次电池。放电时的反应为: PbO2+Pb+2H2SO4 = PbSO4+2H2O,铅蓄电池负极的电极反应式为__________;充电时,铅蓄电池的PbO2极应与外加直流电源的__________极相连,PbO2极的电极反应式为__________ (3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做__________极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为__________
|
|
| 12. | 详细信息 |
|
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)
|
|
| 13. | 详细信息 |
|
某工业废液富含硫酸亚铁,为减少污染并做到废物再利用,某工厂以该工业废液为原料回收硫酸亚铁,并以硫酸亚铁为原料生产氧化铁的工艺如下(部分操作和条件略):
|
|