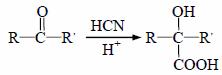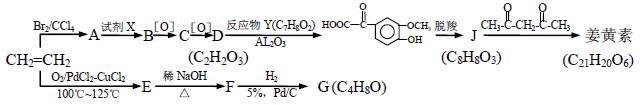2017四川高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学在生产和日常生活中有着重要应用。下列说法不正确的是 A.施肥时,草木灰(有效成份K2CO3)不能与NH4Cl混合使用 B.热的纯碱能去厨房油污是因为其水解呈碱性,可以使油脂水解成水溶性物质 C.在服用胃舒平(主要成分有氢氧化铝)期间可以食用醋、可乐等食品 D.使用含氟牙膏预防龋齿利用了沉淀转化的原理
|
|
| 2. | 详细信息 |
|
下列能发生加成反应的有机物是 A.丙烷 B.甲醛 C.乙酸 D.乙醇
|
|
| 3. | 详细信息 |
|
NA为阿伏伽德罗常数的值,下列说法正确的是 A. 25℃时,1LpH=l的HCl溶液中,由水电离的H+的个数为0.1NA B. 25℃时,0.1mol/LNaHCO3溶液中含有HCO3-数小于0.1NA C.标准状况下,NA个H2O分子所占有的体积约为22.4L D. lmol(NH4)2Fe(SO4)2·6H2O固体中含有离子总数为5NA
|
|
| 4. | 详细信息 |
|
己知某有机物C6H12O2酸性条件下能发生水解反应生成A和B, B能氧化成C。若A、C都能发生银镜反应,则C6H12O2符合条件的结构简式有(不考虑立体异构) A.3种 B.4种 C.5种 D.6种
|
|
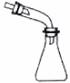
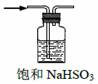
| 5. | 详细信息 | ||||||||||||
|
下列选用的仪器和药品能达到实验目的的是
|
|||||||||||||
| 6. | 详细信息 |
|
100℃时,Kw=1×10-12.下列三种溶液:①0.01mol/LNH4Cl溶液 ②HCl与NaOH溶液等体积混合,所得pH=6的溶液 ③pH= 6.5的NaHCO3溶液。其中呈酸性的是 A.① B.③ C.②③ D.①③
|
|
| 7. | 详细信息 |
|
下列说法正确的是 A.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 B.根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4, 使之转化为疏松、易溶于酸的CaCO3 C.常温下,将醋酸稀溶液加水稀释,溶液中c(H+)/c(CH3COOH)均减小 D. 3H2(g)+WO3 (s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S < 0
|
|
| 8. | 详细信息 |
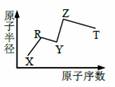
|
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断不正确的是
A. Y、Z组成的化合物只含离子键 B.氢化物的沸点和稳定性排序:R<Y C.最高价氧化物对应的水化物的酸性:T> R D.由X、Y、Z、T四种元素组成的化合物水溶液一定显酸性
|
|
| 9. | 详细信息 |
|
As2S3和HNO3有如下反应: As2S3+10HNO3 = 2H3AsO4 + 3S+ 10NO2↑+ 2H2O,下列说法正确的是 A.该反应的氧化产物仅为S B.生成lmolH3AsO4时转移电子个数为10NA C.将反应设计成一原电池,则NO2应该在正极附近逸出 D.反应产生的NO2与56LO2 (标况)混合在水中正好完全反应生成硝酸
|
|
| 10. | 详细信息 |
|
在某固定体积的绝热密闭容器中进行的可逆反应A (g)+B(g) ①反应容器中压强不随时间变化而变化;②A气体和B气体的生成速率相等;③混合气体的平均摩尔质量不随时间变化而变化;④混合气体的密度不随时间变化而变化⑤化学平衡常数不变 A.①④⑤ B. ③④ C.①③④⑤ D.②③
|
|
| 11. | 详细信息 |
|
下列化学实验事实及解释都正确的是 A.用含有少量硫酸铜的稀硫酸跟锌粒反应,能加快产生氢气,说明Cu2+具有催化能力 B.升高温度会加快化学反应速率,是因为增加了反应物单位体积内活化分子的百分数 C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB D.向MgC12、CuC12混合溶液中逐滴加入少量氨水,先生成Mg (OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
|
|
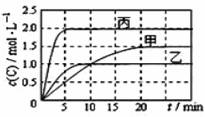
| 12. | 详细信息 | ||||||||||||||||
|
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)
下列说法正确的是 A.由图可知Tl<T2,且正反应为吸热反应 B.前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙 C.平衡时A的转化率a : a乙<a甲<a丙 D. T2时该反应的平衡常数K=1.33
|
|||||||||||||||||
| 13. | 详细信息 |
|
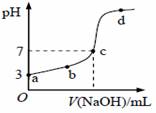
己知常温下CH3COOH的电离常数为K,该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示。下列说法不正确的是
A.c点表示CH3COOH和NaOH恰好完全反应 B.b点表示的溶液中c (CH3COO-)>c(Na+) C.a点表示的溶液中c (CH3COO-)略小于10-3mo1/L D. b、d点表示的溶液中
|
|
| 14. | 详细信息 |
|
25℃时,下列各组离子在指定溶液中可能大量共存的是 A. pH=l的溶液中:Na+、K+、MnO4-、I- B.无色溶液中:Al3+、NH4+、Cl一、S2- C.由水电离出的c(H+)=1×10-3mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- D.0.lmol·L-1FeC13溶液中:Fe2+、NH4+、SCN-、SO42-
|
|
| 15. | 详细信息 |
|
下列说法正确的是 A.为比较氯和硫元素非金属性强弱,可测同条件下同浓度的NaCl溶液和Na2S溶液的pH B.用盐酸滴定氨水可选用甲基橙作指示剂 C.在某溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定含SO42 – D. SO2和Cl2都能使品红溶液褪色,其原理相同
|
|
| 16. | 详细信息 |
|
关于如右图所示装置的说法正确的是
A.溶液中的Cu2+移向N 极 B.该装置将电能转变为化学能 C.若装置用于铁棒镀铜,则M极为铜棒 D. N极发生还原反应
|
|
| 17. | 详细信息 | ||||||||
|
I.下表是几种弱酸常温下的电离平衡常数:
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为_______。 (2)多元弱酸的二级电离程度远小于一级电离的原因是_______。 (3)同浓度的CH3COONa、NaHCO3、Na2CO3、Na2S溶液的pH由大到小的顺序为_____。 II.(l)常温下,0.1 mol/LNaHCO3溶液的pH大于7,则溶液中c(H2CO3)______c(CO32-) (填“>”、“=”或“<”);常温下,己知0.1 mol/LNaHCO3溶液的pH等于8,则溶液中c(H2CO3)-c(CO32-)=______mol/L(写出计算数值结果)。 (2)c(NH4+)相等的①(NH4)2SO4 ②(NH4)HSO4③(NH4)2CO3④ NH4Cl四种溶液,其物质的量浓度由大到小的顺序为________。 (3)等体积等浓度的Ba(OH)2与NH4Cl的混合溶液中各种离子浓度大小关系为(由大到小排列)____________。
|
|||||||||
| 18. | 详细信息 |
|
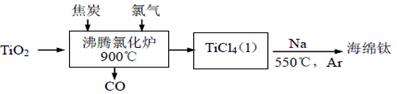
常温下钛的化学活性很小,在较高温度下可与多种物质反应。 (1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
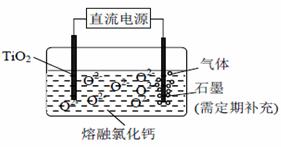
① 沸腾氯化炉中发生的主要反应为:_____________。 ② 己知:Ti (s)+2Cl2(g)=TiCl4(l) △H=akJ/mol; 2Na(s)+Cl2(g)=2NaCl(s) △H=bkJ/mol; Na(s) = Na (l) △H=ckJ/mol 则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s) △H=________kJ/mol ③ TiCl4遇水强烈水解,写出其水解的化学方程式________。 (2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示。二氧化钛电极连接电源_____极,该极电极反应为__________。
(3)若以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,多孔石墨为电极构成的燃料电池提供上述电解的电源,则该电池工作时负极的电极反应式为____________。
|
|
| 19. | 详细信息 |
|
碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构示意图:
回答下列问题: (1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_______。 (2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、______。 (3)C60属于_____晶体,石墨属于______晶体。 (4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的______共价键.而石墨层内的C-C间不仅存在_____共价键,还有______键。 (5)金刚石晶胞含有_____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a , 根据硬球接触模型,则r =_____a。
|
|
| 20. | 详细信息 |
|
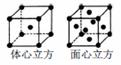
A、B、C、D为前三周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题: (1)当n = 2时.AB2属于____分子(填“极性”或“非极性”) ,分子中有____个σ键、___个π键。A6H6分子中A原子的杂化轨道类型是______杂化。 (2)当n = 3时,A与B形成的晶体属于______晶体。 (3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。 (4)己知某红紫色配合物的组成为CoCl3 ·5NH3· H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为_______。 (5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为________。
|
|
| 21. | 详细信息 |
|
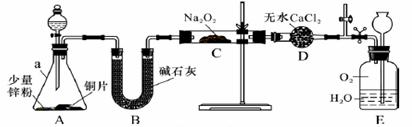
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究。 【查阅资料】① NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;③2NaNO3 【实验探究1】 兴趣小组的同学经讨论设计了如下图所示实验:
(l)仪器a的名称是_______;干燥管D的作用是_______; (2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是_______; (3)若无B装置,后果是_______; (4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是_______; 【实验探究II】 该兴趣小组进一步探究一中生成的白色固体的成分。 (5)提出假设:假设1.白色固体只有NaNO2;假设2.白色固体只有_____;假设3.白色固体是NaNO2和NaNO3 两种物质的混合物。 (6)实验验证: ① 要证明假设2是否成立,实验操作、现象和结论是______________。 ② 为证明是假设l还是假设3成立,称取C中生成的白色固体ag置于坩埚中(坩埚质量为cg),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为bg,假设3成立时b~c的数字范围是__________。(用含a的不等式表示) (二)选考题(共25分) 请考生从二个模块的试题中任选一模块的试题作答,并在答题卡上把所选模块、题号填在对应位置。注意所做题目的题号必须与所选填模块、题目的题号一致,并将答案写在答题卡上的对应位置;只能选同一模块的二个小题,如多选模块,则按第一题计分。
|
|
| 22. | 详细信息 |
|
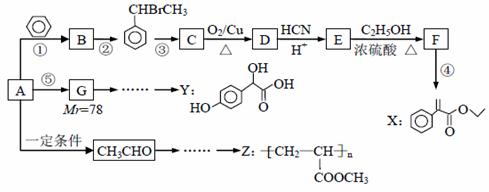
以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。
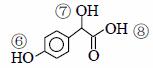
已知: II.反应①、反应②、反应⑤的原子利用率均为100%。 请回答下列问题: (1)B的名称为______,X中的含氧官能团名称为________,反应③的条件为_____,反应④ 的反应类型是__________。 (2)关于药物Y ( A.药物Y的分子式为C8H8O4,遇氯化铁溶液可以发生显色反应 B. lmol药物Y与H2、浓溴水中的Br2反应,最多消耗H2、Br2分别为4 mol和2 mol C. lmol 药物Y与足量的钠反应可以生成22.4L氢气 D.药物Y中⑥、⑦、⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦ (3)写出反应E→F的化学方程式__________。 (4)写出符合下列条件的E的所有同分异构体的结构简式_________。 ① 属于酚类化合物,且是苯的对位二元取代物;② 能发生银镜反应和水解反应。 (5)设计一条以CH3CHO及CH3OH 为起始原料合成Z的线路(无机试剂及溶剂任选)。
|
|
| 23. | 详细信息 |
|
姜黄素是从姜科植物中提取的一种色素,它的主要药理作用有抗氧化、保肝护肝、抑制肿瘤生长等,它具有对称性结构。
请根据以上信息回答下列问题: (1)生成A的反应类型是______,试剂X的名称是_________。 (2)写出下列反应的化学方程式 A→B : _____________;E→F : _____________。 (3)G的核磁共振氢谱峰面积之比________。 (4)J (C8H8O3)的同分异构体中同时满足如下条件:① 能与NaHCO3反应,② 能使FeCl3溶液显色,共有______种(不考虑立体异构),其中苯环上的一氯代物有两种的同分异构体的结构简式是_______。 (5)姜黄素的结构简式___________。
|
|