2019江西高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
为建设生态文明、构建环境友好型社会,下列有关做法不符合这一要求的是( ) A.在大力推广乙醇汽油的同时,研究开发太阳能电池和氢燃料电池汽车 B.大力发展农村沼气, 将废弃的农作物秸秆转化为清洁、 高效的能源 C.研发高效低毒农药,降低蔬菜的农药残留量 D.以聚苯乙烯全面代替木材,生产包装盒、 快餐盒等以减少木材的使用,保护森林
|
|
| 2. | 详细信息 |
|
决定化学反应速率的主要因素是 ( ) A. 催化剂 B.参加反应的物质本身的性质 C. 温度、压强以及反应物的接触面 D. 反应物的浓度
|
|
| 3. | 详细信息 |
|
下列反应中,属于吸热反应的是( ) A. Ba(OH)2·8H2O与NH4Cl反应 B. 灼热的炭与O2反应 C. 铝与稀盐酸 D. 铝粉与氧化铁粉末反应
|
|
| 4. | 详细信息 |
|
下列关于热化学反应的描述,正确的是( ) A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol C.需要加热才能发生的反应一定是吸热反应 D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
|
|
| 5. | 详细信息 |
|
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g) A. 增加铁的量 B. 将容器的体积缩小一半 C. 压强不变,充入氮气使容器体积增大 D. 加入催化剂
|
|
| 6. | 详细信息 |
|
已知4NH3+5O2=4NO+6H2O,若反应速率分别用V(NH3)、V(O2)、V(NO)、V(H2O) 表示。则正确的关系是( ) A. C.
|
|
| 7. | 详细信息 |
|
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是( ) A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mol﹣1 B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1 C. D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
|
|
| 8. | 详细信息 |
|
密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g) A.70% B.60% C.40% D.50%
|
|
| 9. | 详细信息 |
|
对于3Fe(s)+4H2O(g) A.K= C.K=
|
|
| 10. | 详细信息 |
|
可确认发生了化学平衡移动的是( ) A.化学反应速率发生了改变 B.有气态物质参加的可逆反应达到平衡后,改变了压强 C.某一条件的改变,使正、逆反应速率不再相等 D.可逆反应达到平衡后,使用了催化剂
|
|
| 11. | 详细信息 |
|
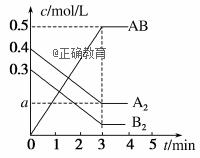
在一个容积为2 L的密闭容器中,加入0.8 mol A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) ===2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
A.图中a点的值为0.15 B.该反应的平衡常数K=0.03 C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5%
|
|
| 12. | 详细信息 |
|
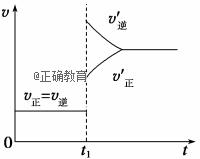
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)
A.容器内气体的颜色变深,混合气体的密度增大 B.平衡不发生移动 C.I2(g)转化率增大,HI平衡浓度变小 D.改变条件前后,速率图像如图所示
|
|
| 13. | 详细信息 |
|
可逆反应aA(g)+bB(g)
A. a+b>c+d T1>T2ΔH>0 B. a+b>c+d T1<T2ΔH<0 C. a+b<c+d T1>T2ΔH>0 D. a+b<c+d T1<T2ΔH<0
|
|
| 14. | 详细信息 |
|
一定条件下反应2AB(g) A. 容器中的总压强不随时间变化而变化 B. 容器内,3种气体AB、A2、B2共存 C. AB的消耗速率等于A2的消耗速率 D. 单位时间内生成n molA 2 ,同时生成2n molAB
|
|
| 15. | 详细信息 |
|
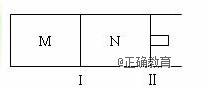
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y B.若x:y=1∶2,则平衡时,M中的转化率:A>B C.若x:y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90% D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正>v逆
|
|
| 16. | 详细信息 |
|
下列热化学方程式中ΔH代表燃烧热的是( ) A.CH4(g)+ C.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH3 D.2CO(g)+O2(g)= ==2CO2(g) ΔH4
|
|
| 17. | 详细信息 |
|
可逆反应mA(g)+nB(g)===pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。 (1)用“>”、“=”或“<”填空: 该反应的ΔH______0,m+n______p。 (2)用“增大”“减小”或“不变”填空(其他条件不变):
|
|
| 18. | 详细信息 |
|
对于可逆反应CO(g)+H2O(g) (1)830 K时,若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为 ;平衡常数K的值为 。 (2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为 。 (3)若830 K时,起始浓度c(CO)=a mol·L-1,c(H2O)=b mol·L-1,H2的平衡浓度c(H2)=c mol·L-1,当a=b时,则a= c。
|
|
| 19. | 详细信息 | ||||||||||||||||||||||||||||
|
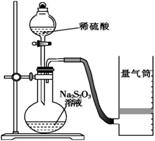
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。 Ⅰ.测定化学反应速率 该同学利用如图装置测定化学反应速率。 (1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。 (2)圆底烧瓶中所发生反应的离子方程式为___________。 (3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。 Ⅱ.探究化学反应速率的影响因素 为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
(4)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
|
|||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
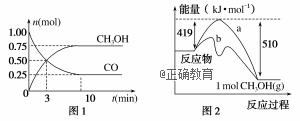
某温度时,在2L密闭容器中CO和H2合成CH3OH(g),反应过程中CO和CH3OH(g)的物质的量随时间的变化如图1所示。
(1)从反应开始至10min末,CO的平均反应速率为______mol·L-1·min-1。若此段时间内H2的平均反应速率为0.075 mol·L-1·min-1,则合成甲醇的化学方程式为 。 (2)图2表示生成1molCH3OH(g)时的能量变化。曲线 (填“a”或“b”)表示使用催化剂时反应的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。 (3)当反应进行到3min末时,下列说法正确的是 (填字母)。 A.上述反应达到平衡状态 B.3 min后该反应的正反应速率逐渐增大 C.CO和CH3OH(g)的物质的量浓度相等 D.用CO和CH3OH(g)表示的化学反应速率相等
|
|
| 21. | 详细信息 | |||||||||||||||||||||||||
|
(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。 已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = — a KJ/mol C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= —b KJ/mol (1)试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有: 甲:CO2(g)+3H2(g) 乙:CO2(g)+H2(g) ①CO(g)+2H2(g) ②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。 ③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为 (填字母符号)。 (3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g) ①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为 。 ②三个容器中一定达到平衡状态的是容器 (填写容器代号)。
|
||||||||||||||||||||||||||

 恒容下加入
恒容下加入