2017河南高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列说法中不正确的有 ①铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 ②Al2O3熔点高,可用于制作耐高温仪器 ③SiO2有导电性,可用于制备光导纤维 ④二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 ⑤金属活动性不同,冶炼方法也有所不同 ⑥明矾常作为消毒剂 ⑦透闪石的化学成分为Ca2Mg5Si8O22(OH)2写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O ⑧镁铝合金的强度和硬度都比纯铝和纯镁大 ⑨除去铜器表面铜绿而不损伤器物,可用稀硝酸 ⑩ Al(OH)3药剂适合于胃溃疡患者服用,治疗胃酸过多 A. ①③⑤ B. ⑦⑧⑨ C. ⑤⑧⑨ D. ③④⑨⑥
|
|
| 2. | 详细信息 |
|
下列离子方程式正确的是 A. 向NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH- B. 向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2 C. H218O 中投入Na2O2固体:2H218O+2Na2O2 D. 向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O
|
|
| 3. | 详细信息 |
|
下列有关物质结构的表述正确的是 A. 次氯酸的结构式:H—Cl—O B. 中子数为20的氯原子: C. 四氯化碳的电子式:
|
|
| 4. | 详细信息 |
|
在下列化学反应中,既有离子键、极性键断裂,又有离子键、极性键形成的是: A. Na2O+H2O=2NaOH B. SO2+H2O=H2SO3 C. Cl2+H2O=HCl+HclO D. 4Li+O2=2Li2O
|
|
| 5. | 详细信息 |
|
把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( ) A. a>b>c>d B. a>c>d>b C. c>a>b>d D. b>d>c>a
|
|
| 6. | 详细信息 |
|
下列各分子中所有原子都满足最外层为8电子结构的是 A. H2O B. BF3 C. Cl2 D. PCl5
|
|
| 7. | 详细信息 |
|
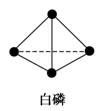
科学家已获得极具理论研究意义的N4分子,其结构为正四面体,(如图所示),与白磷分子相似。已知断裂1molN -N键吸收193kJ热量 ,形成1molN
A. N4分子中含有4个N- N键 B. 1mol N4气体转化为N2时需要吸收724kJ 能量 C. N4是N2的同位素 D. 1mol N4气体转化为N2时放出724kJ 能量
|
|
| 8. | 详细信息 |
|
下列说法中不正确的有( )个 ①反应速率用于衡量化学反应进行的快慢 ②可逆反应达到化学平衡状态时,正、逆反应速率都为0 ③决定反应速率的主要因素是反应物的性质 ④适当增大反应物浓度,提高反应温度都能增大反应速率 ⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。 ⑥可逆反应A(g) ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 C. 4 个 D. 5个
|
|
| 9. | 详细信息 |
|
将0.2mol MnO2和50ml 12mol·L-1盐酸混合后缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀,物质的量为x mol(不考虑盐酸的挥发),则x的取值范围是 A. x=0.3 B. x<0.3 C. 0.3<x<0.6 D. 以上结论都不对
|
|
| 10. | 详细信息 |
|
在一定温度下,下列叙述不是可逆反应A(气)+3B(气) ①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB ③A、B、C的浓度不再变化 ④恒容下,混合气体的密度不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化 ⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2 A. ②⑧ B. ②⑤⑧ C. ①③④⑦ D. ②⑤⑥⑧
|
|
| 11. | 详细信息 |
|
10ml某气态烷烃在50ml氧气里充分燃烧,得到液态水和体积为35ml的混合气体(所有气体都是在同温同压条件测定)则该烃可能是 A. 甲烷 B. 乙烷 C. 丙烷 D. 丁烷
|
|
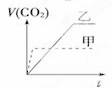
| 12. | 详细信息 |
|
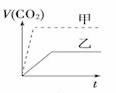
甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量); 乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量); 下列CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是 A. C.
|
|
| 13. | 详细信息 |
|
将1mol甲烷和适量的氯气混合后光照,充分反应后生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳四种有机物的物质的量依次增大0.1 mol,则参加反应的氯气的物质的量为 A. 1.5 mol B. 3 mol C. 4.5 mol D. 6 mol
|
|
| 14. | 详细信息 |
|
在光照条件下分子式为C5H12的烷烃与氯气发生取代反应,生成物中含有两个氯原子且氯原子位于相邻碳原子上的结构最多有 A. 3种 B. 4种 C. 5种 D. 6种
|
|
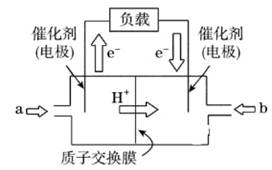
| 15. | 详细信息 |
|
如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是
A. 左边的电极为电池的负极,a处通入的是甲醇 B. 每消耗3.2 g氧气转移的电子为0.4 mol C. 电池负极的反应式为CH3OH+H2O−6e−===CO2+6H+ D. 电池的正极反应式为O2+2H2O+4e−===4OH−
|
|
| 16. | 详细信息 |
|
两种气体A、B分别为0.6 mol与0.5 mol。在0.4 L密闭容器中发生反应:3A(g)+B(g) A. m的值为2 B. 改变压强,该平衡状态发生改变 C. A的平均反应速率为0.1 mol·(L·min)-1 D. 平衡时,反应混合物的总物质的量为1 mol
|
|
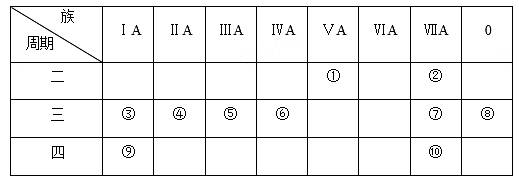
| 17. | 详细信息 |
|
下图是元素周期表的一部分,针对表中的⑩种元素,用元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为______________。 (2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是_________。 (3)⑤的单质与氢氧化钠溶液反应的化学方程式为_______________________。 ⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为_______________________。 (4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为_____________。 (5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式________________________。 (6)写出下列物质的电子式: ①形成的单质______; ⑥与⑩形成的物质________; 用电子式表示④与⑦所组成物质的形成过程___________。
|
|
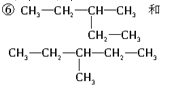
| 18. | 详细信息 |
|
下列各组物质中(1)互为同分异构体的是________,(2)互为同素异形体的是________,(3)互为同位素的是________,(4)属于同一物质的是_______。(5)属于同系物的是_________。 ①C(CH3)4和C4H10 ② ③35Cl和37Cl ④ ⑤石墨和金刚石
⑦(CH3)2CHCH(CH3)2和(CH3)2CH(CH2)2CH3 ⑧H2 D2 T2 ⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3 ⑩CH2=CH-CH2CH3和CH2=CH2
|
|
| 19. | 详细信息 |
|
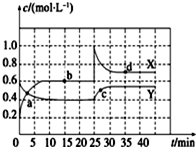
在恒温条件下将一定量X和Y的混合气体通入一容积为2 L!http://www.wln1_00.com *未来脑教_学云平台的密闭容器中,X和Y两物质的浓度随时间变化情况如图。
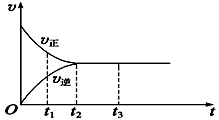
(1)该反应的化学方程式为 (反应物或生成物用符号X、Y表示): _________________。 (2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。 Ⅱ. (3)如图是可逆反应X2+3Y2
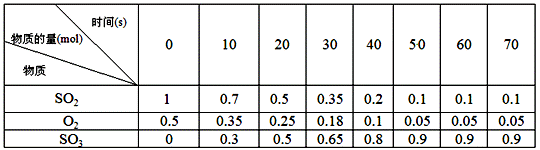
A. t1时,只有正方向反应 B. t2时,反应达到限度 C. t2http~t3,反应不再发生 D. t2~t3,各物质的浓度不再发生变化 Ⅲ. 以下是关于化学反应2SO2+O2 素材1:某温度和压强下,2L容器中,不同时间点测得密闭体系中三种物质的物质的量
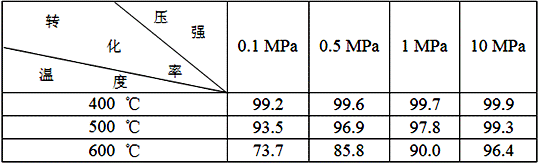
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)
根据以上的两个素材回答问题: (4)根据素材1中计算20~30 s期间,用二氧化硫表示的化学反应平均速率为________。 (5)根据素材2中分析得到,提高该化学反应限度的途径有_______________。 (6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应具体条件是__________________。
|
|
| 20. | 详细信息 |
|
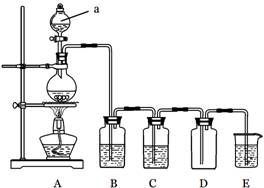
下图是实验室中制备气体或验证气体性质的装置图
(1)仪器a的名称是 。 (2)利用上图装置制备纯净、干燥的氯气。 ①圆底烧瓶内发生反应的离子方程式为 。 ②装置B中的溶液为 ;烧杯中溶液的作用为 。 (3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。 圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。 ①证明SO2具有漂白性的装置是 ,现象是 ; ②证明SO2具有还原性的现象是 ; ③证明生成气体中含有CO2的现象是 ; ④D装置的作用是 。
|
|
| 21. | 详细信息 |
|
已知某烃A 在标况下的密度是3.215克 /升,取 7.2克A跟足量氧气充分燃烧.把燃烧后的产物全部通过浓硫酸,浓硫酸增重10.8克,再把剩余气体通过碱石灰,碱石灰增重22克, (1)该烃的摩尔质量为_______________, (2)确定该有机物的分子式_______________, (3)已知该烃的一氯代物只有一种,写出该烃的结构简式_______________。
|
|
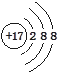
 B.
B. 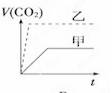
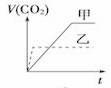 D.
D.