浙江省宁波市2020-2021年高二上册期末九校联考化学题免费试卷
| 1. 选择题 | 详细信息 |
|
下列属于盐的是 A.MgO B.HNO3 C.Fe2O3·nH2O D.CH3COONa |
|
| 2. 选择题 | 详细信息 |
|
下列属于弱电解质的是 A.NaHCO3 B.NH3∙H2O C.AlCl3 D.CCl4 |
|
| 3. 选择题 | 详细信息 |
|
下列模型表示的烃或烃的衍生物中,可以发生酯化反应的是 A.  B. B. C. C.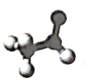 D. D. |
|
| 4. 选择题 | 详细信息 |
|
下列物质的名称与其化学式对应的是 A.碳铵:(NH4)2CO3 B.硬脂酸:C17H33COOH C.肥田粉:(NH4)2SO4 D.氯仿:CH2Cl2 |
|
| 5. 选择题 | 详细信息 |
|
下列物质的水溶液因水解而呈酸性的是 A.NaHCO3 B.FeSO4 C.Ca(ClO)2 D.NaHSO4 |
|
| 6. 选择题 | 详细信息 |
|
下列说法不正确的是 A.用浸泡过高锰酸钾溶液的硅藻土可以保鲜水果 B.铁的表面镀锡防止铁生锈是牺牲阳极的阴极保护法 C.金属材料电镀时,通常以待镀金属制品为阴极,以镀层金属为阳极 D.将纯碱溶于热水可以增强其去污效果 |
|
| 7. 选择题 | 详细信息 |
|
煤的液化可获得乙醇: A.反应物的总能量小于生成物的总能量 B.在绝热密闭容器中进行时,平衡常数不再改变则说明已达平衡状态 C.使用合适的催化剂、增大压强均有利于提高原料的平衡转化率 D.升高温度可增大活化分子的数目及有效碰撞频率,因而温度越高乙醇平衡产率越高 |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A.新戊烷与2,2-二甲基丙烷互为同分异构体 B.H3COOCH和CH3COOCH3互为同系物 C.35Cl2和37Cl2互为同素异形体 D.碳纳米管和金刚石互为同位素 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是 A.1mol乙烯最多能与5 molCl2发生反应 B.苯与溴水的混合液在光照条件下能发生取代反应 C.乙炔与乙烯混合物可通过溴的四氯化碳溶液分离 D.1,3-丁二烯能在较高温度与溴单质发生1,2-加成反应 |
|
| 10. 选择题 | 详细信息 |
|
技术在推动化学学科发展、提高人类生活水平等方面发挥了重要作用。下列说法不正确的是 A.采用分子筛固体酸作为催化剂生产乙苯工艺大幅度降低了对环境的污染 B.比色分析是化学反应速率的一种实验测定方法 C.同位素示踪法常用于研究化学反应历程 D.质谱法常用于判断有机化合中含有哪些基团 |
|
| 11. 选择题 | 详细信息 |
对于反应2SiHCl3(g)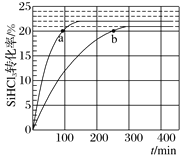 A.该反应的△H>0 B.a、b处反应速率大小关系:va大于vb C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度 D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02 |
|
| 12. 选择题 | 详细信息 |
|
常温下,关于10-4mo1·L-1的盐酸和pH=4的醋酸两种溶液的比较,下列说法不正确的是 A.两溶液中c(H+)相等 B.中和体积相等的两溶液,所需NaOH的物质的量相同 C.分别与大小、形状相同的金属铁反应,初始反应速率相同 D.分别加水稀释100倍,盐酸pH变化大 |
|
| 13. 选择题 | 详细信息 |
科学家发明了一种新型Zn-CO2水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。 下列说法正确的是 A.放电时,正极反应为 B.放电时,1 mol CO2转化为 HCOOH,转移的电子数为4mol C.充电时,电池总反应为 D.充电时,电解质溶液2中OH-浓度升高 |
|
| 14. 选择题 | 详细信息 |
|
已知 A.将0.3molZ置于容器中充分反应生成气体的物质的量一定小于0.3mol B.达到化学平衡状态时,反应吸收的总热量可达akJ C.升高反应温度,逆反应速率增大,正反应速率也增大 D.将0.3molZ置于容器中充分反应气体平均摩尔质量不再改变时,达到化学平衡状态 |
|
| 15. 选择题 | 详细信息 |
|
下列各组有机物只用一种试剂无法鉴别的是( ) A.乙醇、甲苯、硝基苯 B.四氯化碳、己烷、己烯 C.苯、甲苯、环己烷 D.苯、乙醇、乙酸 |
|
| 16. 选择题 | 详细信息 |
根据能量变化示意图,下列说法不正确的是 A.相同质量的NO2(g)和N2O4(g),前者具有较高的能量 B. C. D. |
|
| 17. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||||
以反应
下列说法正确的是 |
|||||||||||||||||||||||||||||||||||
| 18. 选择题 | 详细信息 |
|
0.1mol/L明矾溶液 100mL中,加入0.1mol/L的 Ba(OH)2溶液,当SO42-恰好沉淀完全时,同时得到的氢氧化铝的物质的量为( ) A.0.01mol B.0.005mol C.0.0133mol D.0.0mol |
|
| 19. 选择题 | 详细信息 | ||||||||||||
利用合成气(主要成分为CO和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
则△H为 |
|||||||||||||
| 20. 选择题 | 详细信息 | ||||||||
已知部分弱酸的电离常数如表所示:
|
|||||||||
| 21. 选择题 | 详细信息 |
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和催化剂的条件下,两容器中各自发生下列反应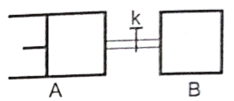 A.反应开始时,B容器中化学反应速率快 B.A容器中X的转化率为40%,且比B容器中X的转化率大 C.打开K一段时间达平衡时,A的体积为2.4aL(连通管中气体体积不计) D.打开K达新平衡后,升高B容器温度,A容器体积会增大 |
|
| 22. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||
一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应
下列说法正确的是 |
|||||||||||||||||||||||||||||||||
| 23. 选择题 | 详细信息 |
以酚酞为指示剂,用0.1000mo1·L-1的NaOH溶液滴定20.00mL的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如下图所示。 下列叙述正确的是 A.曲线①代表δ(H2A),曲线②代表δ(HA-) B.H2A溶液的浓度为0.2000mo1·L-1 C.HA-的电离常数 D.加入NaOH溶液20.00mL时,溶液中 |
|
| 24. 选择题 | 详细信息 |
实验探究是进行科学发现、创造的实践活动。某溶液X中可能含有 则下列说法正确的是 A.若含有Fe3+,一定含有Cl-、K+ B. C. D.气体甲、沉淀甲一定为纯净物 |
|
| 25. 填空题 | 详细信息 |
|
按要求回答下列问题: (1)含40.0 g NaOH的稀溶液与含24.5gH2SO4的稀硫酸反应,放出28.7kJ的热量,表示该反应中和热的热化学反应方程式_______。 (2)钢铁发生吸氧腐蚀的正极反应式_______。 (3)衡量一个体系_______的物理量叫做熵。 (4)甲苯和浓硝酸、浓硫酸的混合酸在100℃时反应生成TNT的化学方程式_______。 (5)写出如图所示高分子化合物的单体_______。  |
|
| 26. 填空题 | 详细信息 |
|
无机化合物A和NaH都是重要的还原剂,遇水都强烈反应。一定条件下,2.40gNaH与气体B反应生成3.90g化合物A和2.24L(已折算成标准状况)的H2.已知气体B可使湿润红色石蕊试纸变蓝。请回答下列问题: (1)A的化学式是_______。 (2)NaH与气体B反应生成化合物A的化学方程式_______。 |
|
| 27. | 详细信息 | ||||||||||||
|
(1)某温度(t℃)时,测得0.01 mo1∙L-1的NaOH溶液的pH=11,则该温度下水的kW=_______。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液Vb L混合。若所得混合液的pH=10,且a=12,b=2,则:Va ︰Vb=_______。 (2)室温时,向100mL0. 1 mo1∙L-1NH4HSO4溶液中滴加0.1 mo1∙L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是_______:在b点,溶液中阳离子浓度由大到小的排列顺序是_______。  (3)煤燃烧排放的烟气含有SO2和NO,采用碱性的 NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_______。 |
|||||||||||||
| 28. 实验题 | 详细信息 | ||||||||||||||||
|
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验,请完成下列填空: (1)配制100mL0.1000 mol∙L-1NaOH标准溶液。 滴定操作步骤:①准备:检漏→洗涤→_______→_______→排气泡→读数。 ②滴定:用移液管取25.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用标准NaOH溶液进行滴定,重复上述滴定操作2-3次,记录数据如下。
(2)滴定达到终点的标志是_______。 |
|||||||||||||||||
| 29. | 详细信息 | ||||||||||||
|
随着天然气在世界能源结构比例增大,煤间接气化制备天然气是当前研究热点,其核心工艺是CO和CO2的甲烷化反应,目前研究人员主要寻找高催化活性的催化剂,同时着力解决产生的积碳对催化剂活性的影响,主要反应如下: 反应Ⅰ: 反应Ⅱ: 反应Ш: 其对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度变化如下表所示:
回答下列问题: |
|||||||||||||
| 30. | 详细信息 |
以煤为原料可合成涂料H(如下图)。B分子式为C2H6O,能与钠反应放出氢气。(注:流程中某些反应条件没有给出)。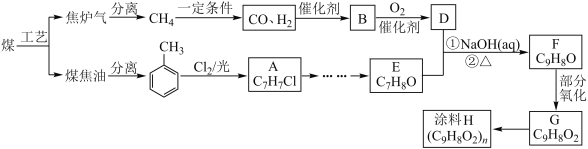 已知: (1) (2) (3)G能与碳酸氢钠溶液反应 请回答: (1)B的结构简式是_______,F中含有的官能团名称是_______。 (2)G→H反应的化学方程式_______。 (3)对于化合物E,下列说法正确的是_______。 A.能发生银镜反应 B.能使Br2的CCl4溶液褪色 C.能发生水解反应 D.能与金属钠反应 (4)与有机物G具有相同官能团的芳香族同分异构体的结构简式为_______。 (5)完成从 |
|







