2020辽宁高三上学期人教版(2019)高中化学开学考试
| 1. | 详细信息 |
|
化学与生产、生活密切相关。下列叙述正确的是 A.煤的干馏和石油的分馏均属化学变化 B.BaSO4在医学上用做钡餐,Ba2+对人体无毒 C.14C可用于文物的年代鉴定,14C与12C互为同素异形体 D.葡萄糖注射液不能产生丁达尔现象,不属于胶体
|
|
| 2. | 详细信息 |
|
中国传统文化对人类文明贡献巨大。下列古代文献涉及的化学研究成果,对其说明不合理的是 A.《天工开物·五金》中记载:“若造熟铁,则生铁流出时,相连数尺内……众人柳棍疾搅,即时炒成熟铁。”炒铁是为了降低铁水中的碳含量,且熟铁比生铁质地更硬,延展性稍差 B.《抱朴子·黄白》中“曾青涂铁,铁赤色如铜”主要发生了置换反应 C.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到蒸馏 D.《梦溪笔谈》中“以剂钢为刃,柔铁为茎,不尔则多断折”中的剂钢是指铁的合金
|
|
| 3. | 详细信息 |
|
NA表示阿伏加德罗常数,下列叙述正确的是 A.向1L 0.3mol·L−1 NaOH溶液中通入0.2mol CO2,溶液中CO B.2L 0.5mol·L−1硫酸钾溶液中阴离子所带电荷数为NA C.1mol FeI2与足量氯气反应时转移的电子数为3NA D.100g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
|
|
| 4. | 详细信息 |
|
陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是 A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
|
|
| 5. | 详细信息 |
|
下列说法中正确的是 A.干冰、液态氯化氢都是电解质 B.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 C.有单质参加或生成的反应不一定属于氧化还原反应 D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
|
|
| 6. | 详细信息 |
|
下列离子方程式书写正确的是 A.澄清石灰水与过量的小苏打溶液反应:Ca2++OH−+HCO B.酸性高锰酸钾溶液与稀草酸反应:5C2O C.AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2−===Ag2S+2Cl− D.NH4HCO3溶液加入过量NaOH溶液加热:NH
|
|
| 7. | 详细信息 |
|
稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是 A.铈(Ce)元素在自然界中主要以化合态形式存在 B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI===CeI4+2H2↑ C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+===Ce3++Fe3+ D.四种稳定的核素
|
|
| 8. | 详细信息 |
|
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法正确的是
A.不可以判断混合物中是否含有Al2O3 B.由图可知X中一定存在Fe2O3 C.混合物X中含0.64g Cu D.Ⅰ中发生的反应的离子方程式为Cu+2H+===Cu2++H2↑
|
|
| 9. | 详细信息 |
|
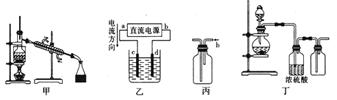
采用如图所示装置和操作,不能达到实验目的的是
A.甲装置:在乙醇与乙酸的混合液中加入足量生石灰,可蒸馏出乙醇 B.若采用乙装置铝件镀银,则d极为铝件,c极为纯银,电解质溶液为AgNO3溶液 C.丙装置b口进气排空气法不可收集CO2、NO等气体 D.丁装置是实验室制取收集纯净氯气的替代装置
|
|
| 10. | 详细信息 |
|
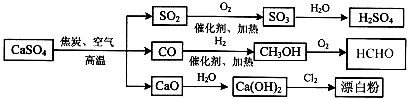
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是 A.CO、SO2、SO3均是酸性氧化物 B.工业上利用Cl2和澄清石灰水反应来制取漂白粉 C.除去与水反应,图示转化反应均为氧化还原反应 D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
|
|
| 11. | 详细信息 |
|
下列各组离子在指定溶液中一定能大量共存的是 ①透明溶液中K+、Na+、MnO A.①④ B.③④⑥ C.④ D.③⑥
|
|
| 12. | 详细信息 | |||
|
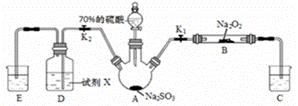
如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是
A.关闭K2,打开K1,滴加硫酸,则装置B中每消耗1mol Na2O2,转移电子数为NA B.关闭K1,打开K2,试剂X是酸性KMnO4 或FeCl3溶液,均可证明SO2有还原性 C.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
|
||||
| 13. | 详细信息 | ||||||||||||||||||
|
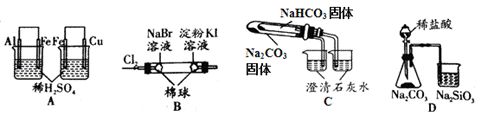
根据下列实验现象,所得结论正确的是
|
|||||||||||||||||||
| 14. | 详细信息 |
|
X、Y、Z、W四种物质在一定条件下具有如图所示转化关系,下列判断正确的是
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 C.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 D.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
|
|
| 15. | 详细信息 |
|
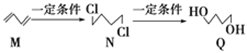
下图为有机物M、N、Q的转化关系,有关说法正确的是
A.M生成N的反应类型是取代反应 B.N的同分异构体有6种 C.可用酸性KMnO4溶液区分N与Q D.0.3mol Q与足量金属钠反应生成6.72L H2
|
|
| 16. | 详细信息 |
|
下列离子方程式不正确的是 A.Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO B.金属钠和水反应:2Na+2H2O===2Na++2OH−+H2↑ C.2mol二氧化碳通入含3mol NaOH的溶液:2CO2+3OH−===HCO D.二氧化硫与氯化铁溶液反应:SO2+2Fe3++2H2O===2Fe2++SO
|
|
| 17. | 详细信息 | ||||||||||||
|
硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。 Ⅰ.Na2S2O3·5H2O的制备 Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3+S+5H2O 制备过程如下: ①称取12.6g Na2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。 ②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。 ③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。 ④趁热过滤,得滤液至蒸发皿中,_____________________________。 ⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。 (1)加入的硫粉用乙醇润湿的目的是__________________________。 (2)步骤④趁热过滤的原因__________________,空格处应采取的操作是_____________________________。 (3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。 (4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是________________________。 Ⅱ.产品纯度的测定 准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g·mol−1),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol·L−1 I2的标准溶液滴定,反应的离子方程式为:2S2O
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。 Ⅲ.产品的应用 (6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2氧化为SO
|
|||||||||||||
| 18. | 详细信息 |
|
某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。 (2)加入30%H2O2的目的是__________________________________。 (3)用萃取分液的方法除去溶液中的Fe3+, ①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是_________________。 ②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是__________________。 (4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol·L−1)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。 已知:①Ksp[Al(OH)3]=1.0×10-33;②pH=8.5时,Mg(OH)2开始沉淀 (5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
|
|
| 19. | 详细信息 |
|
呋喃(
回答下列问题: (1)呋喃和吡咯所含元素中:电负性最大的是___________(填元素符号),第一电离能最大的元素的基态原子电子排布图是______________________。 (2)呋喃分子中,碳原子的杂化方式是___________,1mol吡咯分子中含________molσ键。 (3)NH3与H2O可与Zn2+形成配合物[Zn(NH3)3(H2O)]2+。与Zn2+形成配位键的原子是___________(填元素符号);H2O的空间构型为___________;写出一种与NH3互为等电子体的阳离子:___________(填化学式)。 (4)NH3的相对分子质量比N2O的小,但其沸点却比N2O的高,其主要原因是___________。
|
|
| 20. | 详细信息 |
|
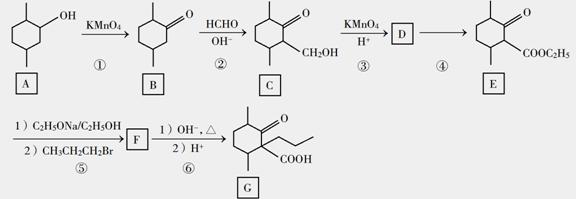
化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题: (1)A中的官能团名称是 。 (2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出B的结构简式,用星号(*)标出B中的手性碳 。 (3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式 。(不考虑立体异构,只需写出3个) (4)反应④所需的试剂和条件是 。 (5)⑤的反应类型是 。 (6)写出F到G的反应方程式 。
|
|