2017高二上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
化学与生产、生活密切相关,下列说法正确的是( ) A. 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 B. 明矾可用于水的消毒、杀菌 C. 焰火的五彩缤纷是某些金属元素物理性质的展现 D. 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
|
|
| 2. | 详细信息 |
|
下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是 ( ) C.与等物质的量的NaOH恰好中和 D.溶液中c(Na+)>c(CO32-)
|
|
| 3. | 详细信息 |
|
下列解释事实的方程式不正确的是( ) A. 测得0.1 mol·L-1氨水的pH为11:NH3·H2O
C. 水垢中的CaSO4用Na2CO3溶液处理:Ca2++ CO32- === CaCO3 ↓ D. 向5 mL 0.1 mol·L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:
|
|
| 4. | 详细信息 |
|
四种短周期元素在周期表中的相对位置如右下图所示,其中Y为空气中含量
A.元素W位于第三周期第ⅦA族 B.Y、Z都是植物必需的元素 C.原子半径:W>Z>Y>X D.X氧化物的大量排放导致化学烟雾
|
|
| 5. | 详细信息 |
|
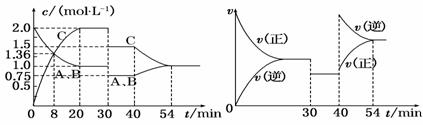
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
A.30~40 min间该反应使用了催化剂 B.化学方程式中的x=1,正反应为吸热反应 C.30 min时降低温度,40 min时升高温度 D.8 min前A的反应速率0.08 mol·L-1·min-1
|
|
| 6. | 详细信息 |
|
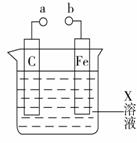
对下图装置的叙述错误的是( )
B.X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 C.X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程
|
|
| 7. | 详细信息 |
|
下列比较中,前者大于后者的是( ) A.25℃时,AgCl固体分别在蒸馏水和0.1mol/LNaCl溶液中的溶解度 B.氢氧化钠分别与稀盐酸和稀硫酸反应的中和热 C.25℃时,浓度均为0.1mol/L的醋酸钠和碳酸钠两溶液的PH D.PH均为4的盐酸和CuCl2两溶液中水的电离程度
|
|
| 8. | 详细信息 |
|
一定条件下,将3 mol A和1 mol B两种气体混合于容积为2 L的密闭容器中,发生反应:3A(g)+B(g) A.2 min内A的平均反应速率为0.3 mol/(L·s) B.混合气体的密度不再改变时,该反应不一定达到平衡状态 C.B的转化率为60% D.该条件下此反应的平衡常数约为0.91
|
|
| 9. | 详细信息 |
|
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( ) A.温度升高,三者都增大 B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大 C.反应2SO2(g)+O2(g) 的转化率可能增大、减小或不变 D.平衡常数的大小与温度、浓度、压强、催化剂等有关
|
|
| 10. | 详细信息 |
|
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中杂质的离子,下述方法正确的是( ) A.加入纯Cu将Fe2+还原 B.向溶液中加入(NH4)2S使Fe2+沉淀 C.直接加水加热使杂质离子水解除去 D.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
|
|
| 11. | 详细信息 |
|
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色草酸(H2C2O4)溶液,反应离子方程式是:2MnO A. 酸式滴定管未用标准液润洗就直接注入KMnO4标准液 B. 滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 C.酸式滴定管尖嘴部分在滴定前有气泡,滴定后没有气泡 D.读取KMnO4标准液时,开始读数正确,滴定结束时俯视读数
|
|
| 12. | 详细信息 |
|
.硝酸生产中,500℃时,NH3和O2可能发生如下反应: ①4NH3(g)+5O2(g) ②4NH3(g)+4O2(g) ③4NH3(g)+3O2(g) 其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是( ) A.减小压强 B.降低温度 C.增大O2浓度 D.使用合适的催化剂
|
|
| 13. | 详细信息 |
|
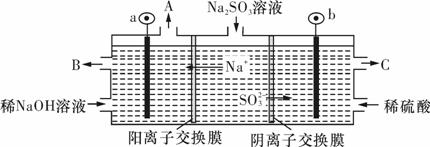
.工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( ) 已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度) A.碳棒上发生的电极反应: 4OH--4e-===O2↑+2H2O B.电解过程中,B中NaCl溶液的物质的量浓度将不断减小 C.为了提高Ni的产率,电解过程中需要控制废水pH D.若将图中阳离子膜去掉,将A、B两室合并,则电解总反应式发生改变
|
|
| 14. | 详细信息 |
|
室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( ) A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA)
|
|
| 15. | 详细信息 |
|
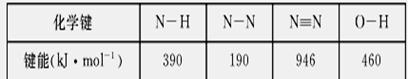
(12分)(1)二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。目前工业上用的捕碳剂NH3和(NH4)2CO3,它们与CO2发生如下可逆反应: 2NH3(l)+H2O(l)+CO2(g) NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq)+H2O(l)+CO2(g) 则K3= (用含K1、K2的代数式表示) (2)现有0.1 mol·L-1的纯碱溶液,请用离子方程式表示纯碱溶液呈碱性的原因: ____________________________________________________; 为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:___________________________________________________________________ (3)肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂。 已知
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是 。 (4)Na2S溶液中离子浓度由大到小的顺序为 向该溶液中加入少量固体CuSO4,溶液pH____(填“增大”、“减小”或“不变”)。
|
|
| 16. | 详细信息 |
|
下列各种溶液中,可能大量共存的离子组是( ) A.pH=1的溶液中:Fe2+、NO B.由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中:Na+、AlO C.含有大量Fe3+的溶液中:Na+、SCN-、K+、NO D.c(H+)=10-14 mol·L-1的溶液中:Mg2+、NO
|
|
| 17. | 详细信息 |
|
短周期元素X、Y、Z、L、M的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,其中Z元素的最高价氧化物对应水化物与其氢化物化合生成盐,M元素的最外层电子数等于其电子层数。请回答下列问题: (1)L的元素符号为 ;M在元素周期表中的位置为 ;上述五种元素的原子半径从大到小的顺序是 (用具体元素符号表示)。 (2)Z、X两元素按原子个数比l∶3和2∶4分别构成分子A和B,A的电子式为 。 (3)由X、Y、Z、L四种元素组成的化合物中,请写出一种既含有共价键又含有离子键的物质 (用化学式作答,下同),一种只含有共价键的物质 。
|
|
| 18. | 详细信息 |
|
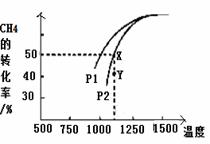
研究含氮、硫污染物的治理是环保的一项重要工作。 (1)①N2(g)+O2(g)═2NO(g) △H1 ②2C(s)+O2(g)═2CO(g) △H2 ③C(s)+O2(g)═CO2(g) △H3 则2NO(g)+2CO(g)=N2(g)+2CO2(g)△H= (用△H1、△H2、△H3表示)。 (2)工业上常用醋酸二氨合亚铜 [Cu(NH3) 2] AC溶液(AC为CH3COO-)来吸收某合成气中的CO,其反应为:[Cu(NH3) 2] AC(aq)+NH3(g)+CO(g)
压强P1 P2(填 “大于”或“小于”),理由是 ; 压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 (4)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离平衡常数Ka=9.6×10﹣4,NaNO2溶液中存在平衡NO2- +H2O (5)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
b极的电极反应式为 。
|
|
| 19. | 详细信息 |
|
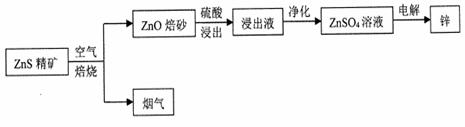
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________。 (2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质, 会影响锌的电解,必须除去。净化过程如下: ①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为 ______________________ 。 ②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用 的试剂为_____ (填字母) A.NaOH B.NH3·H2 O C.ZnO D.H2 SO4 ③用Zn除去Cu2+和Cd2+。 ④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一 温下该反应的平衡常数K=_____________ [已知室温下Ksp(Ag2SO4)=6.0x 10-5,Ksp(AgCl)=2.0x 10-10]。 (3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在 极(填“阳” 或“阴”)析出,阳极反应式为__________ 。
|
|
| 20. | 详细信息 |
|
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-
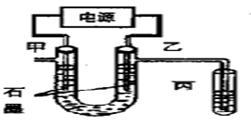
(1)甲电极的电极反应式为 。 。 |
|