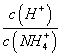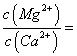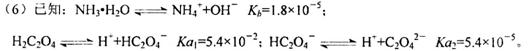2016山东高三下学期鲁科版高中化学高考模拟
| 1. | 详细信息 |
|
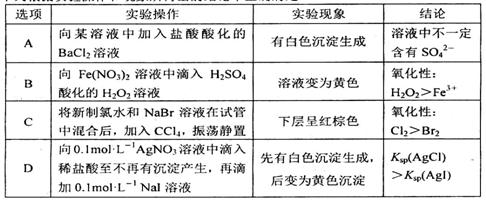
明代《天工开物》记载“火法”冶炼锌: A.倭铅是指金属锌和铅的混合物 B.煤炭中起作用的主要成分是C C.冶炼Zn的反应方程式为:ZnCO3+2C D.该冶炼锌的方法属于热还原法
|
|
| 2. | 详细信息 |
|
下列化学用语表示正确的是 A.中子数为20的氯原子: C.硫化氢的结构式:H—S—H D.氯化铵的电子式:
|
|
| 3. | 详细信息 |
|
|
|
| 4. | 详细信息 |
|
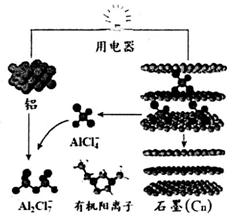
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石 A.放电时,铝为负极、石墨为正极 B.充电时的阳极反应为: Cn+ AlCl4--e-= Cn AlCl4 C.放电时的负极反应为: Al-3e-+7 AlCl4-===4A12C17- D.放电时,有机阳离子向铝电极方向移动
|
|
| 5. | 详细信息 |
|
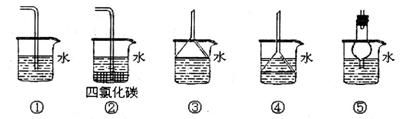
下列有关电解质溶液中粒子浓度关系正确的是 A.pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 B.含等物质的量的NaHSO3和Na2SO3的溶液: 2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合: C(NH3·H2O)>c(Cl-)>c(NH4+)> D.含有AgCl和AgI
|
|
| 6. | 详细信息 |
|
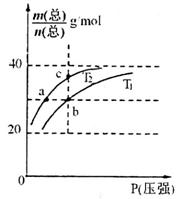
已知:(HF)2(g) A.温度:T1< T2 B.平衡常数:K(a)=K(b)<K(c) C.反应速率:v(b)>v(a) D.当
|
|
| 7. | 详细信息 |
|
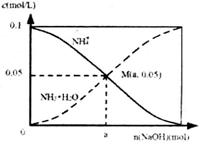
常温下向1L 0.1mol·L-1NH4C1溶液中,不断加入NaOH固体后,NH4+与NH3·H2O浓度的变化趋势如右图所示(不考虑溶液体积变化和氨气的挥发),下列说法不正确的是 A.M点溶液中水的电离程度比原溶液小 B.在M点时,n(OH-)-n(H+)=(a-0.05)mol C.随着NaOH的加入, D.
|
|
| 8. | 详细信息 |
|
I.已知C1O2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒。实验室制备C1O2是用亚氯酸钠固体与氯气反应:2NaClO2+C12==2C1O2+2NaCl,装置如下图所示:
(2)B、C、E装置中的试剂依次为____________________ a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水 (3)以下装置既能吸收尾气又能防止倒吸的是_____________
II.用C1O2处理后的自来水中,C1O2的浓度应在0.10~0.80mg·L-1之间。用碘量法检测水中C1O2浓度的实验步骤如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10-4mol·L-1的Na2S (4)加入的指示剂是___________,达到滴定终点时的现象是____________________________________________________________________________ (5)碘化钾反应的离子方程式是________________________________。 (6)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中C1O2的浓度是____mg·L-1。
|
|
| 9. | 详细信息 |
|
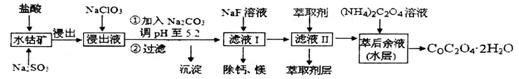
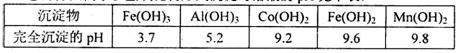
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是_______________。 (2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为____________________________________________________________________________ (3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_______________________________________________________
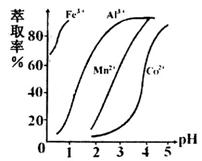
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”) (7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热, 600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是________________________________
|
|
| 10. | 详细信息 |
|
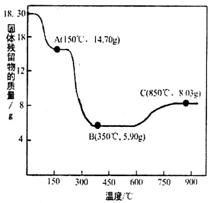
(1)CO2和H2在一定条件下可以生成乙烯: 6H2(g)+2CO2(g) 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= (2)上述生成乙烯的反应中,温度对C
①温度越高,催化剂的催化效率越高 ②温发低于250℃时,随着温度升高,乙烯的产率增大 ③M点平衡常数比N点平衡常数大 ④N点正反应速率一定大于M点正反应速率 ⑤增大压强可提高乙烯的体积分数
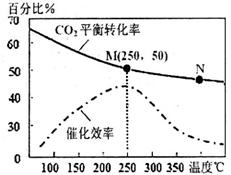
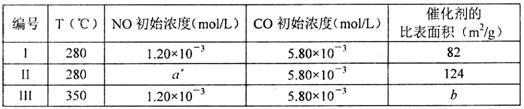
阴极的电极反应式为:_________________________ II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为: 2NO(g)+2CO(g) (4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如下图:
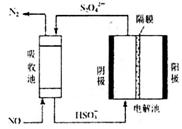
②实验说明,该反应是__________反应(填“放热”或“吸热”)。 ③若在500℃时,投料 (5)使用电化学法也可处理NO的污染,装置如右图。已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。吸收池中除去NO的离子方程式为:__________________________________。
|
|
| 11. | 详细信息 |
|
H2O和CS2分子中的原子都达到稳定结构。 (1)上述四种元素电负性由大到小的顺序是:___________________。 (2)上述四种元素第一电离能比同周期相邻两种元素都小的元素是:_______。 (3)CS2分子中 (4)用“大于”、“小于”或“等于”回答本问题: ①CS2在其晶体中的配位数_______H2O在其晶体中的配位数
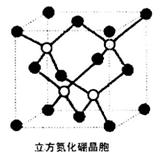
(5)已知TiCl4熔点为37℃,沸点为136℃,熔融态不导电,可知TiCl4为____晶体。 (6)六方氮化硼(BN)的晶胞结构如右图所示。
②硼原子的杂化方式为_________。 ③晶胞边长为a nm则其密度为____g·cm-3(设阿伏加德罗常数的值为NA)
|
|
| 12. | 详细信息 |
|
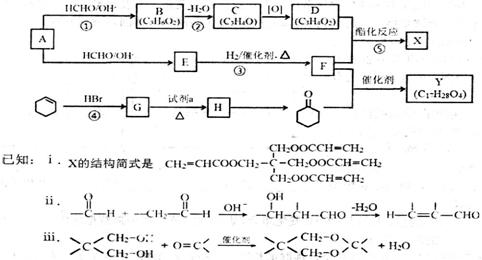
工业上可由A和环己烯(
(1)B中含氧官能团的名称是___________。 (2)A的结构简式是______________。 (3)任选1种具有反式结构的C的同系物,用结构简式表示其反式结构_______。 (4)反应②、③、④、⑤中与反应①的类型相 (5)G→H的化学方程式是__________。 (6)E的结构简式是________________。
|
|