2020дёҠжө·й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еҗҲзү©дёӯпјҢеұһдәҺејұз”өи§ЈиҙЁзҡ„жҳҜВ В пјҲВ В пјү AпјҺHClВ В В В В В В В BпјҺH2OВ В В В В В В В CпјҺKOHВ В В В В В В DпјҺCH3COONaВ В
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©еёёеҺӢдёӢпјҢдёӢеҲ—ж°”дҪ“еңЁж°ҙдёӯжә¶и§ЈеәҰжңҖеӨ§зҡ„жҳҜпјҲВ В пјү В В A. Cl2В В В В В В В В В В B. CO2В В В В В В В В В В C.NH3В В В В В В В В В В D. N2
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зӣҗзҡ„ж°ҙжә¶ж¶Іе‘Ҳй…ёжҖ§зҡ„жҳҜпјҲВ В пјү В В A.NaClВ В В В В В B.В Na2CO3В В В C. CH3COONaВ В В В В D.AlCl3
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶжҹҗеҢ–иӮҘжә¶дәҺж°ҙпјҢжөӢеҫ—жә¶ж¶Ізҡ„pHеӨ§дәҺ7пјҢиҜҘеҢ–иӮҘжҳҜпјҲВ В В пјү AгҖҒKNO3 В В В В В В BгҖҒNH4NO3 В В В В В В В В CгҖҒпјҲNH4пјү2SO4 В В В В В В DгҖҒK2CO3
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
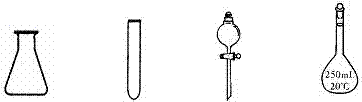
е®һйӘҢе®Өдёӯй…ҚеҲ¶250mL 0.10mo1/LNaOHжә¶ж¶Іж—¶пјҢеҝ…йЎ»дҪҝз”ЁеҲ°зҡ„зҺ»з’ғд»ӘеҷЁжҳҜпјҲВ В В пјү
В В AпјҺй”ҘеҪўз“¶гҖҖгҖҖгҖҖBпјҺиҜ•з®ЎгҖҖгҖҖCпјҺеҲҶж¶ІжјҸж–—гҖҖгҖҖгҖҖDпјҺе®№йҮҸ瓶
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еҗҲзү©дёӯпјҢеұһдәҺејәз”өи§ЈиҙЁзҡ„жҳҜ пјҲВ В В пјү В
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёҚиғҪз”ЁеҚ•иҙЁеҢ–еҗҲиҖҢжҲҗзҡ„жҳҜпјҲВ В В В пјү AВ CuSВ В В В В В В В В BВ FeSВ В В В В В В В CВ FeCl3В В В В В В В DВ HgS
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҜ№зЎ«й…ёзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜВ пјҲВ В В В пјү A. еӣ жө“зЎ«й…ёе…·жңүејәж°§еҢ–жҖ§пјҢж•…дёҚеҸҜз”Ёе®ғжқҘе№ІзҮҘж°Ёж°” B. жө“зЎ«й…ёдёҚжҙ»жіјпјҢеҸҜз”Ёй“Ғй“қе®№еҷЁеӯҳж”ҫ C. жө“зЎ«й…ёйҡҫжҢҘеҸ‘пјҢеҸҜз”ЁжқҘеҲ¶зЎқй…ёгҖҒзӣҗй…ёзӯүжҢҘеҸ‘жҖ§й…ё D.жө“зЎ«й…ёжңүејәж°§еҢ–жҖ§пјҢзЁҖзЎ«й…ёдёҚе…·жңүж°§еҢ–жҖ§
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯпјҢиө·еӣәж°®дҪңз”Ёзҡ„жҳҜВ пјҲВ В пјү В В В AгҖҒ N2дёҺH2еңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗNH3В В В В В В BгҖҒ NOдёҺO2еҸҚеә”з”ҹжҲҗNO2 CгҖҒNH3з»ҸеӮ¬еҢ–ж°§еҢ–з”ҹжҲҗNOВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DгҖҒ з”ұNH3еҲ¶зЎ«й…ёй“ө
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜ•еүӮдёӯпјҢеҸҜд»ҘйүҙеҲ«дәҢж°§еҢ–зўіе’ҢдәҢж°§еҢ–зЎ«ж°”дҪ“зҡ„жҳҜпјҲВ В пјү A. жҫ„жё…зҹізҒ°ж°ҙВ В В В В В В В В В В В В В В В В В В В В B.е“Ғзәўжә¶ж¶ІВ В В В В В В C. ж№ҝж¶Ұзҡ„зҜ®иүІзҹіи•ҠиҜ•зәёВ В В В В В В В В В В В В D.зЎқ酸银жә¶ж¶І
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҪұе“Қеӣ зҙ дёӯпјҢдёҚеұһдәҺеҪұе“ҚеҢ–еӯҰ平衡移еҠЁзҡ„жҳҜпјҲВ В пјү AпјҺжё©еәҰВ В В В В В В В В В BпјҺжө“еәҰВ В В В В В В В В CпјҺеӮ¬еҢ–еүӮВ В В В В В В В В В В DпјҺеҺӢејә
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
2A (g) В AгҖҒйҷҚеҺӢВ В В В В BгҖҒеҠ еӮ¬еҢ–еүӮВ В В CгҖҒеҚҮжё© В В В В В В В DгҖҒйҷҚжё©
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ё3е…Ӣеқ—зҠ¶еӨ§зҗҶзҹідёҺ30жҜ«еҚҮ3ж‘©/еҚҮзӣҗй…ёеҸҚеә”еҲ¶еҸ–CO2ж°”дҪ“пјҢиӢҘиҰҒеўһеӨ§еҸҚеә”йҖҹзҺҮпјҢеҸҜйҮҮеҸ–зҡ„жҺӘж–ҪжҳҜпјҡпјҲВ В пјү в‘ еҶҚеҠ е…Ҙ30жҜ«еҚҮ3ж‘©/еҚҮзӣҗй…ёгҖҖгҖҖ в‘Ўж”№з”Ё30жҜ«еҚҮ6ж‘©/еҚҮзӣҗй…ё В В в‘ўж”№з”Ё3е…ӢзІүжң«зҠ¶еӨ§зҗҶзҹігҖҖгҖҖгҖҖгҖҖ в‘ЈйҖӮеҪ“еҚҮй«ҳжё©еәҰ В В AпјҺв‘ в‘Ўв‘ЈгҖҖВ В В В В В BпјҺв‘Ўв‘ўв‘ЈгҖҖВ В В CпјҺв‘ в‘ўв‘ЈгҖҖВ В В В В В В В DпјҺ в‘ в‘Ўв‘ў
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҺӘж–ҪдёӯпјҢиғҪеҮҸж…ўеҢ–еӯҰеҸҚеә”йҖҹзҺҮзҡ„жҳҜВ (В В В пјү В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺйЈҹзү©еӮЁеӯҳеңЁеҶ°з®ұйҮҢгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В BпјҺе°Ҷеқ—зҠ¶еӣәдҪ“иҚҜе“Ғз ”з»ҶеҗҺеҶҚеҸҚеә”гҖҖгҖҖгҖҖ CпјҺз”ЁMnO2дҪңH2O2еҲҶи§ЈеҸҚеә”зҡ„еӮ¬еҢ–еүӮ DпјҺз”Ё30% H2SO4жә¶ж¶Ід»Јжӣҝ5% H2SO4жә¶ж¶ІдёҺй”ҢзІ’еҸҚеә”
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—з”өзҰ»ж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ(В В В пјү AпјҺNaOH вҶ’Na++O2пјҚ+ H+В В В В В В В В В В В В В В В В В В BпјҺH2O вҶ’H+ +OHпјҚ CпјҺHClO DпјҺCH3COONH4
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дёӢеҲ—е№іиЎЎдҪ“зі»пјҢж”№еҸҳжқЎд»¶еҗҺе№іиЎЎдёҚдјҡжӯЈж–№еҗ‘移еҠЁзҡ„жҳҜ (В В В )В В A. C(s)+CO2 В C. H2S
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖдҪ“з§ҜдёҚеҸҳзҡ„еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”AпјҲgпјү+3BпјҲgпјүвҶ’2CпјҲgпјүгҖӮејҖе§ӢеҸҚеә”ж—¶пјҢAзҡ„жө“еәҰдёә2mol/LгҖӮеҸҚеә”иҝӣиЎҢ2minж—¶пјҢжөӢеҫ—е®№еҷЁдёӯA зҡ„жө“еәҰдёә1.8mol/LпјҢеҲҷиҜҘ2minеҶ…Aзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮжҳҜ (В В В )В AгҖҒ0.4 mol/L.minВ В В В В В BгҖҒ0.3 mol/L.minВ В В В В CгҖҒ0.2 mol/L.minВ В В В DгҖҒ0.1mol/L.min
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҚиғҪз”ЁеӢ’еӨҸзү№еҲ—еҺҹзҗҶи§ЈйҮҠзҡ„жҳҜ(В В В пјү AпјҺдҪҝз”Ёй“Ғи§ҰеӘ’пјҢеҠ еҝ«еҗҲжҲҗж°ЁеҸҚеә”йҖҹзҺҮВ В BпјҺиҝҮйҮҸз©әж°”жңүеҲ©дәҺSO2иҪ¬еҢ–дёәSO3 CпјҺжү“ејҖжұҪж°ҙ瓶зӣ–пјҢеҚіжңүеӨ§йҮҸж°”жіЎйҖёеҮәВ В DпјҺй…ҚзҪ®FeCl3жә¶ж¶Іж—¶пјҢеҠ е…Ҙе°‘йҮҸзӣҗй…ё
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжқЎд»¶дёӢзҡ„еҜҶй—ӯе®№еҷЁдёӯдёӢеҲ—еҸҚеә”пјҡCO(ж°”)пјӢNO2(ж°”) AпјҺиҜҘжӯЈеҸҚеә”дёәеҗёзғӯеҸҚеә”В В В В В В В В В В В В В В В В В В В В BпјҺиҜҘжӯЈеҸҚеә”дёәж”ҫзғӯеҸҚеә” CпјҺйҷҚжё©еҗҺCOзҡ„жө“еәҰеўһеӨ§В В В В В В В В В В В В В В В В В В DпјҺйҷҚжё©еҗҺеҗ„зү©иҙЁзҡ„жө“еәҰдёҚеҸҳеҢ–
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжё©еәҰдёӢпјҢеӣәе®ҡдҪ“з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”M(g)+N(g) AпјҺv (W)ж¶ҲиҖ—=v (W)з”ҹжҲҗВ В В В В В В В В В В В В В В В В В В В BпјҺvжӯЈ=vйҖҶ=0 CпјҺе®№еҷЁеҶ…еҺӢејәдҝқжҢҒдёҚеҸҳВ В В В В В В В В В В В В В В В DпјҺn(M)вҲ¶n(N)вҲ¶n(W)=1вҲ¶1вҲ¶2
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺеҸҜйҖҶеҸҚеә”mA(g)+nB(g) В В A.йҷҚжё©гҖҒйҷҚеҺӢВ В В В B. еҚҮжё©гҖҒйҷҚеҺӢВ В В В C. йҷҚжё©гҖҒеўһеҺӢВ В В В В D. еҚҮжё©гҖҒеўһеҺӢ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢйқўжҳҜе®һйӘҢе®ӨеҲ¶еҸ–ж°Ёж°”зҡ„иЈ…зҪ®е’ҢйҖүз”Ёзҡ„иҜ•еүӮпјҢе…¶дёӯй”ҷиҜҜзҡ„жҳҜ(В В В пјү
В В В В В В AВ В В В В В В В В В В В В В В BВ В В В В В В В В В В В В В В CВ В В В В В В В В В В В В В В D
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
N2+3H2 A.NH3зҡ„жө“еәҰеўһеӨ§пјҢN2гҖҒH2жө“еәҰжҜ”еҺҹжқҘе°ҸВ В В В B.NH3зҡ„жө“еәҰеўһеӨ§пјҢN2гҖҒH2зҡ„жө“еәҰд№ҹжҜ”еҺҹжқҘеӨ§ C.жӯЈеҸҚеә”йҖҹзҺҮеўһеӨ§пјҢйҖҶеҸҚеә”йҖҹзҺҮеҮҸе°ҸВ В D.иҜҘеҸҳеҢ–дёҚиғҪз”ЁеӢ’еӨҸзү№еҲ—еҺҹзҗҶи§ЈйҮҠ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжә¶ж¶ІдёӯеҸҜеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ(В В В пјү AпјҺK+пјҢClвҖ”пјҢCO32пјҚпјҢNa+В В В В В В В В В В В В В В BпјҺH+пјҢBa2+пјҢNO3пјҚпјҢSO42пјҚ CпјҺ NH4+пјҢSO42пјҚпјҢK+пјҢOH-В В В В В В В В В В В В DпјҺCa2+пјҢNO3пјҚпјҢNa+пјҢCO32пјҚ
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
pH=lзҡ„жә¶ж¶Ідёӯеҗ«жңүNaпјӢгҖҒClвҖ”гҖҒNO3вҖ”пјҢиҝҳеҸҜиғҪеҗ«жңүеӨ§йҮҸзҡ„пјҲВ В В В пјү AпјҺFe3пјӢВ В В В В В В В В В В BпјҺAgпјӢВ В В В В В В CпјҺOHвҖ”В В В В В В В В В В В DпјҺCO32вҖ”
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Ізҡ„жә¶иҙЁйғҪжҳҜејәз”өи§ЈиҙЁпјҢиҝҷдәӣжә¶ж¶Ідёӯзҡ„Cl-жө“еәҰдёҺ50 mL 1 mol/LMgCl2жә¶ж¶Ідёӯзҡ„Cl-жө“еәҰзӣёзӯүзҡ„жҳҜВ (В В В пјү
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҖүйЎ№дёҚиғҪиЎЁзӨәзҰ»еӯҗеҸҚеә”ж–№зЁӢејҸдёәH+ + OHвҖ”вҶ’ H2Oзҡ„жҳҜ (В В В пјүВ AпјҺNaOH + HCl вҶ’ NaCl + H2OВ В В В В В В В В В BпјҺ2NaOH + H2SO4В вҶ’ Na2SO4 + 2H2O CпјҺBa(OH)2 + H2SO4 вҶ’ BaSO4вҶ“ + 2H2OВ В В DпјҺBa(OH)2 + 2HCl вҶ’ BaCl2 + 2H2O
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°®ж°”еҸҜд»ҘеӨ§йҮҸгҖҒзЁіе®ҡең°еӯҳеңЁдәҺз©әж°”дёӯзҡ„еҺҹеӣ жҳҜпјҲВ В В пјү AВ ж°®ж°”жҜ”з©әж°”зЁҚиҪ»В В В В В В В В В В В В В В В В В В BВ ж°®е…ғзҙ зҡ„йқһйҮ‘еұһжҖ§жҜ”ж°§е…ғзҙ зҡ„йқһйҮ‘еұһжҖ§ејә CВ ж°®еҺҹеӯҗзҡ„еҚҠеҫ„жҜ”ж°§еҺҹеӯҗзҡ„еҚҠеҫ„еӨ§ DВ ж°®еҲҶеӯҗдёӯеӯҳеңЁе…ұд»·еҸҒй”®пјҢз ҙеқҸе®ғйңҖиҰҒеҫҲеӨ§зҡ„иғҪйҮҸ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
C. й“Ғи·ҹзӣҗй…ёеҸҚеә”пјҡ2Fe+6 D. зЎ«й…ёдёҺж°ўж°§еҢ–й’Ўжә¶ж¶Іж··еҗҲпјҡ
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
дёӢеҲ—е…ідәҺе®һйӘҢе®ӨеҲ¶еҸ–NH3зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
|
|||||||||
| 31. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иЎЁзӨәејҸдёӯпјҢжӯЈзЎ®зҡ„жҳҜ(В В В пјү В AпјҺйҶӢй…ёзҡ„з”өзҰ»ж–№зЁӢејҸпјҡCH3COOHвҶ’CH3COOдёҖ+ H+ В BпјҺеёёжё©дёӢNH4Clжә¶ж¶Ізҡ„pH < 7 В CпјҺеӣ дёәSO3зҡ„ж°ҙжә¶ж¶ІиғҪеӨҹеҜјз”өпјҢжүҖд»ҘSO3жҳҜејәз”өи§ЈиҙЁ В DпјҺеңЁеёёжё©дёӢзҡ„NaOHжә¶ж¶ІдёӯпјҢз”ұдәҺNaOHжҠ‘еҲ¶дәҶж°ҙзҡ„з”өзҰ»пјҢж°ҙзҡ„зҰ»еӯҗз§Ҝеёёж•°(KW)еҮҸе°Ҹ
|
|
| 32. | иҜҰз»ҶдҝЎжҒҜ |
|
H2Sж°”дҪ“йҖҡе…ҘдёӢеҲ—зү©иҙЁдёӯиғҪдә§з”ҹй»„иүІжІүж·Җзҡ„жҳҜпјҲВ В В В В В пјү AпјҺSO2гҖҖгҖҖгҖҖ BпјҺNaOHжә¶ж¶ІгҖҖгҖҖгҖҖ CпјҺзӣҗй…ёгҖҖгҖҖгҖҖ DпјҺNaClжә¶ж¶І
|
|
| 33. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҜйҖҶеҸҚеә”N2+3H2 AгҖҒ 2VжӯЈпјҲH2пјү=3VйҖҶпјҲNH3пјүВ В В В В В В В В В В В BгҖҒVжӯЈпјҲN2пјү=VйҖҶпјҲNH3пјү CгҖҒ3VжӯЈпјҲN2пјү=VжӯЈпјҲH2пјүВ В В В В В В В В В В В В В В В DгҖҒVжӯЈпјҲN2пјү=3VйҖҶпјҲH2пјү
|
|
| 34. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дёҚеұһдәҺй“өзӣҗжүҖе…ұжңүзҡ„жҖ§иҙЁ(В В )В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺйғҪжҳҜжҷ¶дҪ“В В В В В В В В В В В В В В В В В В В BпјҺйғҪиғҪжә¶дәҺж°ҙ CпјҺеёёжё©ж—¶жҳ“еҲҶи§ЈВ В В В В В В В В В В В В В В DпјҺйғҪиғҪи·ҹзўұеҸҚеә”ж”ҫеҮәж°Ёж°”
|
|
| 35. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҗ«жңүй…ҡй…һзҡ„0.1mol/LNH3.H2OдёӯеҠ е…Ҙе°‘йҮҸзҡ„NH4Clжҷ¶дҪ“пјҢеҲҷжә¶ж¶ІйўңиүІпјҲВ В пјү AгҖҒеҸҳи“қВ В В В В В В В В В В В В BгҖҒеҸҳж·ұВ В В В В В В В В В В В В CгҖҒеҸҳжө…В В В В В В В В В В В В DгҖҒдёҚеҸҳ
|
|
| 36. | иҜҰз»ҶдҝЎжҒҜ |
|
жЈҖйӘҢй“өзӣҗеёёз”Ёзҡ„ж–№жі•жҳҜпјҢеҸ–е°‘йҮҸеҫ…жЈҖзү©ж”ҫе…ҘиҜ•з®ЎдёӯпјҢ然еҗҺиҝӣиЎҢжӯЈзЎ®зҡ„ж“ҚдҪңжҳҜпјҲВ В пјү AпјҺеҠ ж°ҙжә¶и§ЈеҶҚз”ЁзәўиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢе…¶жә¶ж¶І BпјҺеҠ зғӯиҜ•з®Ўе№¶з”Ёж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёжҺҘиҝ‘иҜ•з®ЎеҸЈдёҠж–№ CпјҺеҠ е…Ҙж°ўж°§еҢ–й’ жә¶ж¶ІпјҢеҠ зғӯпјҢ并用ж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёжҺҘиҝ‘иҜ•з®ЎеҸЈдёҠж–№ DпјҺеҠ е…Ҙж°ўж°§еҢ–й’ жә¶ж¶І пјҢеҠ зғӯеҶҚж»ҙе…Ҙй…ҡй…һиҜ•ж¶І
|
|
| 37. | иҜҰз»ҶдҝЎжҒҜ |
|
ж¬Ій…ҚеҲ¶1.00mol/Lзҡ„NaClжә¶ж¶І1000mLпјҢйңҖиҰҒдҪҝз”Ёзҡ„д»ӘеҷЁе’ҢиҚҜе“ҒжҳҜпјҲВ В пјү
|
|
| 38. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺзӣҗзұ»зҡ„ж°ҙи§ЈпјҢиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺзӣҗзұ»ж°ҙи§ЈжҳҜй…ёзўұдёӯе’ҢеҸҚеә”зҡ„йҖҶеҸҚеә”пјҢеӣ иҖҢжҳҜеҗёзғӯеҸҚеә” BпјҺеҲ©з”Ёй“қзӣҗзҡ„ж°ҙи§ЈеҸҜиҝӣиЎҢеҮҖж°ҙ CпјҺеңЁй…ҚеҲ¶ж°ҜеҢ–й“Ғжә¶ж¶Іж—¶пјҢеҠ е…Ҙе°‘йҮҸзҡ„зӣҗй…ёжҳҜдёәдәҶйҳІжӯўFe3+зҡ„ж°ҙи§Ј DпјҺжүҖжңүзӣҗеңЁдёҖе®ҡжқЎд»¶дёӢйғҪеҸҜд»ҘеҸ‘з”ҹж°ҙи§Ј
|
|
| 39. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӨдёӘжә¶ж¶ІеҜјз”өе®һйӘҢиЈ…зҪ®дёӯпјҢеҲҶеҲ«жіЁе…Ҙ30ml 2mol/L зҡ„йҶӢй…ёе’Ң20ml 2mol/L зҡ„ж°Ёж°ҙпјҢзҒҜе…үжҳҺжҡ—еәҰзӣёдјјпјҢеҰӮжһңжҠҠиҝҷдёӨз§Қжә¶ж¶Ізӣёж··еҗҲеҶҚе®һйӘҢпјҢеҲҷпјҲВ В пјү AгҖҒзҒҜе…үеҸҳжҡ—В В В BгҖҒзҒҜе…үеҸҳдә®В В В CгҖҒзҒҜе…үжҳҺжҡ—зЁӢеәҰдёҚеҸҳВ В DгҖҒзҒҜе…үжҳҺжҡ—зЁӢеәҰеҸҳеҢ–дёҚжҳҺжҳҫ
|
|
| 40. | иҜҰз»ҶдҝЎжҒҜ |
|
еӨҡж•°жӨҚзү©дёӯзҡ„иүІзҙ йҒҮй…ёзўұдјҡдә§з”ҹдёҚеҗҢзҡ„йўңиүІгҖӮзҙ«зҪ—е…°еҗ«иүІзҙ HZпјҢHZзҡ„ж°ҙжә¶ж¶Іе‘Ҳзҙ«иүІдё”еӯҳеңЁе№іиЎЎHZ(зәўиүІ) AпјҺзҙ«иүІВ В В В В В В В BпјҺзәўиүІВ В В В В В В В CпјҺи“қиүІВ В В В В В В В В DпјҺж— иүІ
|
|
| 41. | иҜҰз»ҶдҝЎжҒҜ |
|
еҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„з”өзҰ»ж–№зЁӢејҸпјҡ пјҲ1пјүзЎ«й…ёВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ2пјүйҶӢй…ёВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ3пјүж°ҙВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ4пјүж°ўж°§еҢ–й’ЎВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ5пјүж°Ёж°ҙВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
|
|
| 42. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖеӣәе®ҡе®№з§Ҝзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢиҝӣиЎҢеҰӮдёӢеҸҚеә”пјҡ В В В В В В В В В В В В В В C(s)+ H2O(g)В пјҲ1пјүиӢҘе®№еҷЁе®№з§Ҝдёә2LпјҢеҸҚеә”10sж°ўж°”иҙЁйҮҸеўһеҠ 0.4gпјҢеҲҷиҜҘж—¶й—ҙеҶ…дёҖж°§еҢ–зўізҡ„еҸҚеә”йҖҹзҺҮдёә В В В В В В В В В В mol/(LВ·s)гҖӮпјҲ2еҲҶпјү пјҲ2пјүиӢҘеўһеҠ зўізҡ„йҮҸпјҢеҲҷжӯЈеҸҚеә”йҖҹзҺҮВ В В В В В В В В В В В В гҖӮпјҲйҖүеЎ«вҖңеўһеӨ§вҖқгҖҒвҖңеҮҸе°ҸвҖқгҖҒвҖңдёҚеҸҳвҖқпјү пјҲ3пјүиҜҘеҸҚеә”иҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„ж Үеҝ—жҳҜВ В В В В В В В В В В В В гҖӮ aпјҺеҺӢејәдёҚеҸҳ В В В В В В bпјҺvжӯЈ(H2)= vжӯЈ(H2O)В В В В cпјҺc(CO)дёҚеҸҳВ В В d.c(H2O)= c(CO) пјҲ4пјүиӢҘеҚҮй«ҳжё©еәҰпјҢе№іиЎЎеҗ‘еҸіз§»еҠЁпјҢеҲҷжӯЈеҸҚеә”жҳҜВ В В В В В В В В В еҸҚеә”гҖӮпјҲйҖүеЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқпјү
|
|
| 43. | иҜҰз»ҶдҝЎжҒҜ |
|
иҜ·ж №жҚ®з”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙзҡ„е®һйӘҢеҶ…е®№еЎ«еҶҷпјҡ пјҲ1пјү йҳіжһҒдёҺз”өжәҗзҡ„В В В В В жһҒпјҲйҖүеЎ«жӯЈжҲ–иҙҹпјүзӣёиҝһпјӣйҳіжһҒдә§з”ҹВ В В В В В пјҲеЎ«еҢ–еӯҰејҸпјүж°”дҪ“пјӣе®ғзҡ„жЈҖйӘҢж–№жі•жҳҜВ В В В В В В В В В В В В В В В В В В _________гҖӮ пјҲ2пјүйҳіжһҒеҸ‘з”ҹВ В В В В В В еҸҚеә”пјӣйҳҙжһҒеҸ‘з”ҹВ В В В В В В В еҸҚеә”пјҲйҖүеЎ«ж°§еҢ–жҲ–иҝҳеҺҹпјүгҖӮ
|
|
| 44. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүе®һйӘҢе®Өз”Ёж°ўж°§еҢ–й’ жҷ¶дҪ“пјҢй…ҚеҲ¶100mL 0.1mol/Lзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІпјҢжӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸжҳҜпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮпјҲеЎ«еәҸеҸ·в‘ в‘ЎвҖҰпјүгҖӮВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В в‘ и®Ўз®—жүҖз”Ёж°ўж°§еҢ–й’ жҷ¶дҪ“зҡ„иҙЁйҮҸгҖӮ в‘Ўе°Ҷз§°еҘҪзҡ„ж°ўж°§еҢ–й’ жҷ¶дҪ“ж”ҫеңЁе°Ҹзғ§жқҜдёӯпјҢеҠ 30mLж°ҙ в‘ўз”ЁеӨ©е№із§°еҸ–жүҖйңҖж°ўж°§еҢ–й’ жҷ¶дҪ“ в‘Је°Ҷжә¶ж¶ІиҪ¬е…Ҙе®№йҮҸ瓶дёӯ в‘Өж”№з”Ёиғ¶еӨҙж»ҙз®Ўе°ҸеҝғеҠ ж°ҙиҮіеҲ»еәҰ в‘Ҙ继з»ӯеҗ‘е®№йҮҸ瓶дёӯеҠ ж°ҙиҮійЎөйқўжҺҘиҝ‘еҲ»еәҰзәҝ2-3еҺҳзұіеӨ„ в‘Ұз”Ёи’ёйҰҸж°ҙжҙ—ж¶Өзғ§жқҜ2-3ж¬ЎпјҢжҙ—ж¶Өж¶Іе…ЁйғЁиҪ¬е…Ҙе®№йҮҸ瓶дёӯ ⑧зӣ–дёҠ瓶еЎһпјҢжҢҜиҚЎж‘ҮеҢҖгҖӮ пјҲ2пјүеңЁй…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„ж°ўж°§еҢ–й’ жә¶ж¶Іж—¶пјҢиӢҘз§°еҸ–зҡ„еӣәдҪ“ж°ўж°§еҢ–й’ жҪ®и§ЈпјҢеҲҷжә¶ж¶Ізҡ„жө“еәҰВ В В В В В В В В пјӣиӢҘзғ§жқҜжІЎжңүжҙ—ж¶ӨпјҢеҲҷжә¶ж¶Ізҡ„жө“еәҰВ В В В В В В В пјӣиӢҘиҪ¬з§»жә¶ж¶Іж—¶пјҢжңүйғЁеҲҶжә¶ж¶Іжә…еҮәпјҢеҲҷжә¶ж¶Ізҡ„жө“еәҰВ В В В В В В В В пјӣе®ҡе®№ж—¶иӢҘдҝҜи§ҶеҲ»еәҰзәҝпјҢеҲҷжә¶ж¶Ізҡ„жө“еәҰВ В В В В В В В гҖӮпјҲеЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқгҖҒвҖңдёҚеҸҳвҖқпјү
|
|
- 2016-2017е№ҙй«ҳдёҖдёӢжңҹеҢ–еӯҰејҖеӯҰиҖғиҜ•пјҲеұұдёңзңҒзғҹеҸ°з¬¬дәҢдёӯеӯҰпјү
- 2017-2018е№ҙеәҰй«ҳдёү第дёүж¬ЎиҒ”иҖғеҢ–еӯҰиҖғиҜ•пјҲе…ЁеӣҪеҗҚж ЎеӨ§иҒ”иҖғпјү
- 2017-2018е№ҙй«ҳдәҢдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲйҮҚеәҶеёӮ第дёҖдёӯеӯҰпјү
- 2017-2018е№ҙй«ҳдёҖдёҠеҚҠжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•еңЁзәҝжөӢйӘҢпјҲж№–еҢ—зңҒе®ңжҳҢеёӮзӨәиҢғй«ҳдёӯеҚҸдҪңдҪ“пјү
- 2016-2017е№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғиҜ•йўҳпјҲдёҠжө·еёӮйҮ‘еұұдёӯеӯҰпјү
- й»„йҮ‘30йўҳзі»еҲ— й«ҳдәҢеҢ–еӯҰ еӨ§йўҳжҳ“дёўеҲҶ
- 2017-2018е№ҙй«ҳдёүеүҚеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•еңЁзәҝжөӢйӘҢпјҲжІіеҚ—зңҒжҙӣйҳіеёӮпјү
- 2016-2017е№ҙй«ҳдёҖеҗҺеҚҠжңҹеҢ–еӯҰејҖеӯҰиҖғиҜ•еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲзҰҸе»әзңҒеҺҰ门第дёҖдёӯеӯҰпјү