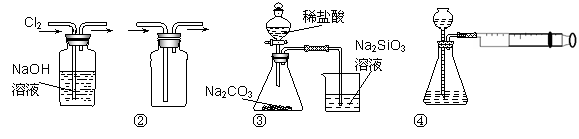2016江苏高三下学期苏教版高中化学月考试卷
| 1. | 详细信息 |
|
水由于受到有机物污染而造成富营养化,使水中鱼类大批死亡,鱼类死亡是因为( ) A.藻类大量繁殖,抢走了鱼类的营养 B.水中缺氧,窒息而死 C.水中氧气过多 D.水中含有毒的重金属元素过多
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数,下列叙述正确的是( ) A、常温下11.2L的甲烷气体含有甲烷分子 数为0.5 NA B.一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA C.12.5 mL 16 mol/L浓硫酸与足量铜反应,转移电子数为0.2 NA D.常温常压下,22.4L的CO2气体的物质的量为1 mol
|
|
| 3. | 详细信息 |
|
酯化反应属于( )。 A.中和反应 B.不可逆反应 C.离子反应 D.取代反应
|
|
| 4. | 详细信息 |
|
我国及美国、日本等国家都已研制出了一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是 A.普通硅酸盐陶瓷 B.氮化硅陶瓷 C.光导纤维 D.玻璃钢
|
|
| 5. | 详细信息 |
|
下列晶体中属于原子晶体的是 A.干冰 B.食盐 C.金刚石 D.氖
|
|
| 6. | 详细信息 |
|
某元素原子价电子构型3d54S2,其应在 A、第四周期ⅡA族 B、第四周期ⅡB族 C、第四周期ⅦA族 D、第四周期ⅦB族
|
|
| 7. | 详细信息 |
|
下列物质的用途叙述错误的是( ) A、硅是制造太阳能电池的常用材料 B、四氧化三铁俗称铁红,可用于作油漆、红色涂料 C、Na2O2可用作呼吸面具中的供氧剂 D、二氧化硅是制造光导纤维的材料
|
|
| 8. | 详细信息 |
|
NA代表阿伏伽德罗常数的值,下列叙述正确的是( ) A.1L1mol/LFeBr2溶液与1mol氯气反应时转移的电子数为3NA B.0.5mol/L硫酸钠溶液中含有溶质离子总数为1.5NA C.1mol硫酸氢钠固体中含阳离子总数NA D.28g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA
|
|
| 9. | 详细信息 |
|
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中 A.一定有SO42- B.可能有SO42-或Ag+ C.一定无Ag+ D.还可能有CO32-
|
|
| 10. | 详细信息 |
|
下列变化中,一定需加还原剂才能实现的是 A.CO2→CO32﹣ B.FeCl3→FeCl2 C.C→CO2 D.HCl→MgCl2
|
|
| 11. | 详细信息 | ||
|
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达错误的是 20080926 C.质量②>③>①>④ D.氢原子个数①>③>④>②
|
|||
| 12. | 详细信息 | |||||||||||||||
|
如表实验“操作和现象”与“结论”对应关系正确的是( )
A.A B.B C.C D.D
|
||||||||||||||||
| 13. | 详细信息 |
|
用下图所示实验装置进行相应实验,能达到实验目的的是( )
A.装置①可用于除去Cl2中含有的少量HCl气体 B.装置④向左推动针筒活塞可检验该装置的气密性 C.装置③可证明非金属性Cl>C>Si D.按装置②所示的气流方向可用于收集H2、NH3等
|
|
| 14. | 详细信息 |
|
下列各项叙述中,正确的是( ) A.钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 C.2p和3p轨道形状均为哑铃形,能量也相等 D.氮原子的价电子排布图:
|
|
| 15. | 详细信息 |
|
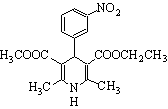
尼群地平片可用于治疗高血压。其主要成分的结构简式如右图所示。下列关于这种化合物的说法正确的是
B.该物质可以和银氨溶液发生银镜反应 C.该物质属于芳香族化合物,能溶于水 D.该物质在酸性条件下不发生水解反应
|
|
| 16. | 详细信息 |
|
古希腊哲学家德谟克利特提出 论;到了19世纪初,英国物理学家和化学家 提出近代原子论,为近代化学发展奠定了基础;到了20世纪初,英国科学家 发现了电子,提出原子的 模型。随着X射线的发现与元素放射性的发现,英国物理学家 在1911年提出了原子的 模型,为原子结构的现代模型打下了基础。
|
|
| 17. | 详细信息 |
|
电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义。 (1)电解方法精炼粗铜,电解液选用CuSO4溶液,精炼过程中电解质溶液的浓度______________(填写“增大”、“减小”或“不变”)。铜在潮湿空气中会被锈蚀,写出该反应的化学方程式______________,锈蚀过程中发生了原电池反应,该电池的正极反应式为______________。 (2)研究发现有机合成反应可形成原电池,既生产产品,又生产电能。例如烯烃生产卤代烃的反应就可制成原电池,若电池总反应表示为:
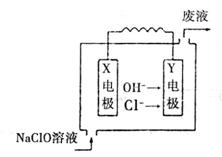
则该原电池的负极反应式为_________________________。 (3)如图为Mg-NaClO燃料电池结构示意图,已知电解质溶液为NaOH溶液,且两电极中一个为石墨电极,一个为镁电极。
Y电极材料为_____________,X电极发生的电极反应式为_____________,若该电池开始时加入1L0.2 mol
|
|
| 18. | 详细信息 |
|
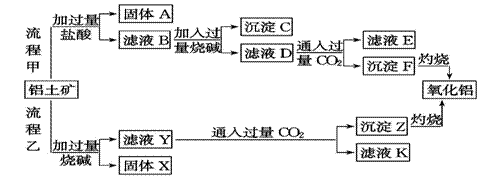
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题: (1)流程甲加入盐酸后生成Al3+的离子方程式为: ; (2)流程乙加入烧碱后生成SiO32-的离子方程式为______。 (3)验证滤液B含Fe3+,可取少量滤液并加入______(填试剂名称)。 (4)滤液E中溶质的主要成分是____(填化学式),写出该溶液的一种用途 。
|
|
| 19. | 详细信息 |
|
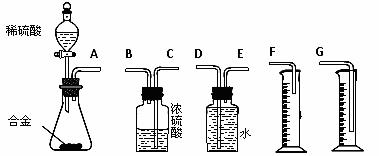
铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。 【方案一】 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。 【方案二】 〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
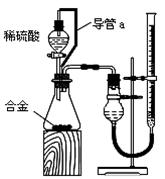
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。 A.待实验装置冷却后再读数 B.上下移动量筒F,使其中液面与广口瓶中液面相平 C.上下移动量筒G,使其中液面与广口瓶中液面相平 D.视线与液体的凹面相平读取量筒中水的体积 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了下图所示的实验装置。
①装置中导管a的作用是 。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。
|
|
| 20. | 详细信息 | ||||||||||||||||||
|
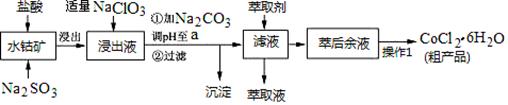
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
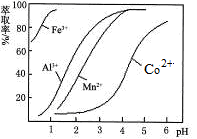
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。 (1)写出浸出过程中Co2O3发生反应的离子方程式________________________。 (2)写出NaClO3发生反应的主要离子方程式____________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________。 (3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 。 (4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。 (5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5 (6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
|
|||||||||||||||||||
| 21. | 详细信息 |
|
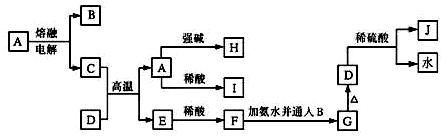
下列各物质的转化关系如下图所示,其中C是一种日常生活中常见的单质,D是一种棕红色固体。
回答下列问题: (1)C的名称为 ;J的化学式为 。 (2)写出由A生成H的离子反应方程式: 。 (3)某气体能使品红溶液褪色,但加热后又恢复,该气体通入J溶液中发生反应的离子方程式: 。
|
|
| 22. | 详细信息 |
|
已知某温度下氢氰酸(HCN)的电离平衡常数是6.4×10-10(mol/L)2。请计算: (1)常温下,1 mol/L的氢氰酸溶液中H+浓度及PH。 (2)在该酸溶液中由水电离产生的氢氧根离子的浓度。
|
|
| 23. | 详细信息 |
|
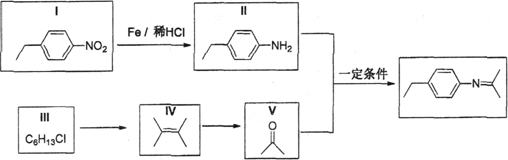
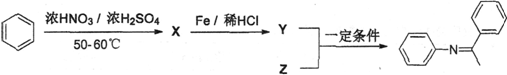
席夫碱类化合物在催化、药物等方面用途广泛。某种席夫碱的合成路线①如下:
(1)Ⅰ的分子式为__________,1mol,V完全燃烧至少需要消耗__________mol O2; (2)III与NaOH水溶液共热反应,化学方程式为___________________________ (3)IV发生聚合反应生成的高分子化合物的结构简式为_____________________ (4)结合合成路线①,分析以下合成路线②:
X的结构简式为__________,Z的结构简式为__________
|
|
| 24. | 详细信息 |
|
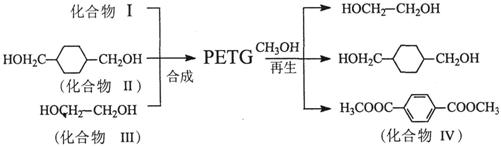
共聚酯(PETG)有着优异的光泽度、透光率和可回收再利用等特点,广泛应用于医疗用品、日常消费品和化妆品包装等行业。PETG的结构简式为:
PETG新材料的合成和再生路线如下:
试回答下列问题: (1)化合物IV的分子式为_______________________________。 (2)化合物I的结构简式:______________;化合物II的一种同分异构体V能与饱和NaHCO3溶液反应放出CO2且分子结构中含有5个甲基,则化合物V的结构简式为__________。 (3)合成的反应类型为____________________________。 (4)化合物Ⅲ可由乙烯与Br2通过发生加成后,得到的产物在一定条件下发生取代反应而获得,请写出发生取代反应的化学方程式:______________________________。 (5)在一定条件下,CH3OH能与碳酸乙烯酯
|
|