2014河北高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
1.(1分)实验是研究化学的基础,下列关于实验操作的叙述中正确的是( ) A.向盛有沸水的烧杯中滴加FeCl3溶液并长时间煮沸,制备Fe(OH)3胶体 B.某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀生成,说明溶液中有SO42﹣ C.钠保存在盛有煤油的细口试剂瓶中 D.配制0.1mol/L的H2SO4溶液时,将量取的浓硫酸倒入容量瓶中加水稀释至刻度线
|
|
| 2. | 详细信息 |
|
分类是化学学习与研究的常用方法,下列分类正确的是( )\ A.非金属氧化物均属于酸性氧化物 B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 C.根据电解质的水溶液导电性的强弱,将电解质分为强电解质和弱电解质 D.根据反应物和生成物的类别以及反应前后物质种类的多少,把化学反应分为化合反应、分解反应、置换反应和复分解反应
|
|
| 3. | 详细信息 | |||||||||
|
等物质的量的钠、镁、铝分别与足量稀盐酸反应,在同温同压下放出H2的体积比为( )
|
||||||||||
| 4. | 详细信息 | ||||||||||
|
已知二氧化硫是酸性氧化物,根据其类别及化合价推测它不具有的性质( )
|
|||||||||||
| 5. | 详细信息 | ||||||||||
|
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
|
|||||||||||
| 6. | 详细信息 | ||||||||||||
|
下列有关金属元素特征的叙述正确的是( )
|
|||||||||||||
| 7. | 详细信息 | ||||||||||||
|
下列离子方程式正确的是( )
|
|||||||||||||
| 8. | 详细信息 | |||||||||
|
一化工厂突发火灾,经消防支队全体官兵的奋力扑救,大火在2小时后被成功扑灭.起火原因经专家分析,是储存在该厂实验室的酒精由于管理不善,酒精滴漏到某种化学品上而酿成火灾.请你判断引起火灾的罪魁祸首的化学品可能是( )
|
||||||||||
| 9. | 详细信息 | ||||||||||
|
已知氧化性:Br2>Fe3+>I2;还原性:I﹣>Fe2+>Br﹣,则下列反应能发生的是( )
|
|||||||||||
| 10. | 详细信息 | |||||||||
|
当溶液中XO42﹣ 和SO32﹣的离子数之比为1:2时,恰好完全发生氧化还原反应,X在还原产物中的化合价为( )
|
||||||||||
| 11. | 详细信息 | ||||||||||||
|
在实验室进行下列实验,括号内的实验用品都能用到的是( )
|
|||||||||||||
| 12. | 详细信息 | |||||||||
|
某学习小组辨析以下说法: ①粗盐和酸雨都是混合物; ②酸性氧化物和碱性氧化物都是电解质; ③冰和干冰既是纯净物又是化合物; ④淀粉溶液和蛋白质溶液可能都是胶体; ⑤盐酸和醋酸既是化合物又是酸; ⑥纯碱和烧碱都是碱. 说法正确的是( )
|
||||||||||
| 13. | 详细信息 | ||||||||||||
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
|
|||||||||||||
| 14. | 详细信息 | ||||||||||||
|
下列叙述中,正确的是( )
|
|||||||||||||
| 15. | 详细信息 | ||||||||||||
|
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是( )
|
|||||||||||||
| 16. | 详细信息 | |||||||||
|
质量分数为n的NaOH溶液,其物质的量浓度为amol/L,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为bmol/L,则a与b的关系正确的是( )
|
||||||||||
| 17. | 详细信息 | |||||||||
|
人造空气(氧气O2与氦气He的混合气)可用于减轻某些病痛或供深水潜水员使用.在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的质量比是( )
|
||||||||||
| 18. | 详细信息 | ||||||||||||
|
下列有关氧化还原反应的叙述正确的是( )
|
|||||||||||||
| 19. | 详细信息 | ||||||||||
|
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
|
|||||||||||
| 20. | 详细信息 | |||||||||
|
下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( ) ①KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;5:1 ②Fe2O3+2Al ③4HC1(浓)+MnO2 ④3NO2+H2O═2HNO3+NO;2:1.
|
||||||||||
| 21. | 详细信息 | |||||||||
|
有KOH和Ca(OH)2的混合溶液.其中OH﹣的物质的量浓度为0.1mol/L,取此溶液500mL,向其中通入CO2,求最多消耗CO2的体积(V)为( )(单位为mL)
|
||||||||||
| 22. | 详细信息 | |||||||||
|
下列各组在溶液中的反应,反应物量不同,离子方程式不同且现象不同的是( )
|
||||||||||
| 23. | 详细信息 | ||||||||||||
|
相同条件下,相同浓度的盐酸分别与镁、铝、铁3种金属恰好完全反应,产生相同体积的氢气(相同状况下),则下列说法正确的是( )
|
|||||||||||||
| 24. | 详细信息 | |||||||||
|
向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( ) ①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体 ④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜 ⑦小球在溶液中沉浮 ⑧小球在液面上游动、逐渐变小,直至消失.
|
||||||||||
| 25. | 详细信息 | |||||||||
|
有两种金属组成的混合物粉末15g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是( )
|
||||||||||
| 26. | 详细信息 | ||||||||||||
|
下列有关金属的说法正确的是( )
|
|||||||||||||
| 27. | 详细信息 | |||||||||
|
在托盘天平右盘上放一个盛有100mL3mol•L﹣1NaOH溶液的烧杯,左盘上放一个盛有100mL3mol•L﹣1盐酸的烧杯,调节天平至平衡,然后在两烧杯中各加入等质量的铝片,反应完全后,则天平可能出现的情况是( )
|
||||||||||
| 28. | 详细信息 | |||||||||
|
将5.4g Al投入200.0mL 2.0mol•L﹣1的某溶液中有氢气产生,充分反应后有金属剩余.该溶液可能为( )
|
||||||||||
| 29. | 详细信息 | |||||||||
|
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42﹣的物质的量浓度为9mol/L,则此溶液最多溶解Mg的质量为( )
|
||||||||||
| 30. | 详细信息 | |||||||||
|
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O→Y+H2;Z+H2O→W+O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
|
||||||||||
| 31. | 详细信息 | ||||||
|
在一次化学研究性学习实验中,某研究小组学生,研究分析某两瓶无标签的试剂,只知道一瓶是固体,另一瓶是液体,取少量两种试剂在试管中混合,立即产生一种无色无味的气体.现请你对此气体开展一系列探究,并完成下列实验报告. (1)①此气体是什么物质(只写出其中可能的一种)?验证它的实验方案如下:
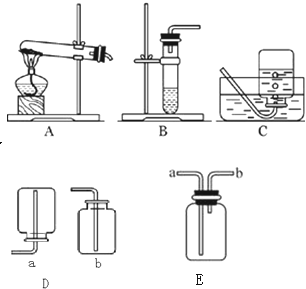
产生此气体的化学方程式可能是 2H2O2 ②想制取该气体(用本题中两瓶无标签的试剂),采用的发生装置可选用下图A、B、C中的 B (对应填序号). 收集该气体可选用D中的 b 装置. ③若图E是收集该气体的装置,气体由 a 端(填“a”或“b”)导入. (2)猜想此无色气体还有无可能是另一种气体,如果有,请写出产生它的化学方程式 CaCO3+2HCl=CaCl2+H2O+CO2↑ (只须写一种).
|
|||||||
| 32. | 详细信息 |
|
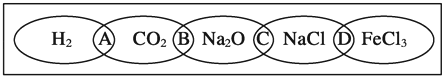
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
(1)请将分类依据代号填入相应的括号内: A 两种物质都不是电解质 C 两种物质都是钠的化合物 B 两种物质都是氧化物 D 两种物质都是盐 (2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色.反应的离子方程式为 Fe3++3H2O═Fe(OH)3(胶体)+3H+ 向制备好的分散系中逐滴加入硫酸能看到什么现象是: 先沉淀后溶解 (3)纳米是长度单位,1纳米等于 10﹣9 米,纳米科学与纳米技术是研究结构尺寸在l~100nm范同内材料的性质与应用. (4)现有一含有FeCl2和FeCl3的混合物样品,采经测定已知n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为 10% .
|
|
| 33. | 详细信息 |
|
(1)氢化钠(NaH)为白色晶体,其中H﹣有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用单线桥标出电子的转移与数目 NaH能与水剧烈反应NaH+H2O═NaOH+H2↑,NaH与液氨也有类似反应,写出反应方程式 NaH+NH3═NaNH2+H2 . (2)有一表面被部分氧化为氧化钠的金属钠试样,欲测其钠的纯度.通过实验可得到下列数据: ①试样的质量为m1g;②水的质量(过量)为m2g;③与水反应过程中生成H2的质量为m3g. a、求试样钠的纯度,不可能用到的数据是 ② (填数据代号). b、请根据能测定钠纯度的组合数据,写出计算钠纯度的数学表达式:
|
|
| 34. | 详细信息 |
|
1)某化学反应的反应物和产物如下: Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2 a、该反应的氧化剂是 NaNO3 . b、该反应的氧化产物是 Al(OH)3、NaAlO2 . C、反应过程中转移5mol e﹣,生成标准状况下N2的体积为 11.2 L. d、配平该氧化还原反应 10 Al+ 6 NaNO3+ 6 H2O═ 4 Al(OH)3+ 3 N2↑+ 6 NaAlO2 (2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的离子方程式为 Fe+2H+=Fe2++H2↑ .
|
|
| 35. | 详细信息 |
|
某研究性学习小组为了了解HCl、NaHSO4、NaHCO3在水溶液中的电离情况,进行了下列实验; ①分别测定了0.1mol/L的HCl、NaHSO4、NaHCO3溶液中H+的物质的量浓度,HCl溶液中c(H+)=0.1mol/L,NaHSO4溶液中c(H+)=0.1mol/L,而NaHCO3溶液中H+的物质的量浓度远远小于0.1mol/L. ②取少量NaHSO4溶液于试管中,滴入BaCl2溶液有不溶于硝酸的白色沉淀生成. ③取少量NaHCO3溶液于试管中,滴入几滴BaCl2无明显现象. (1)请根据该小组同学的实验结果,分别写出NaHSO4、NaHCO3在水溶液中的电离方程式: ①NaHSO4: NaHSO4=Na++H++SO42﹣ 、 ②NaHCO3: NaHCO3═Na++HCO3﹣ 、 (2)写出②中反应的离子方程式: SO42﹣+Ba2+=BaSO4↓ .
|
|
| 36. | 详细信息 |
|
将质量为2.3g钠用刺了孔的铝箔包裹后放入水中,共收集到2.464L(标准状况)气体.请回答下列问题: (1)2.3g钠与水反应,理论上生成气体的体积(标准状况)为多少. (2)反应后溶液的体积为100mL,则混合溶液中NaOH的物质的量浓度为多少?
|
|