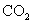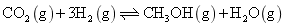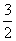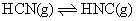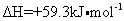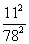内蒙古2020-2021学年高二上学期期中考试化学试题含解析
| 1. | 详细信息 |
|
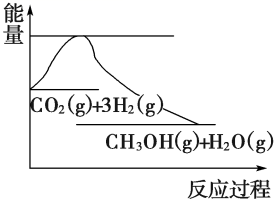
实现 “ 节能减排 ” 和 “ 低碳经济 ” 的一个重要课题就是如何将 A . C . |
|
| 2. | 详细信息 |
|
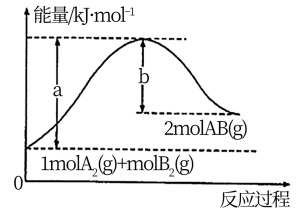
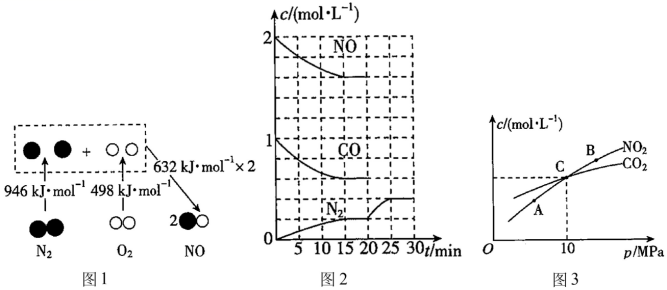
键能是指在 298 K、1.01×10 5 Pa ,将 1 mol 理想气体分子 AB 拆开为中性气态原子 A 和 B 时所需要的能量。已知键能: H-H 为 436 kJ·mol − 1 ; Cl-Cl 为 243 kJ·mol − 1 ; H-Cl 为 431 kJ·mol − 1 。下列说法中不正确的是 A . 1 mol H 2 中的化学键断裂时需要吸收 436 kJ 能量 B . 2 mol HCl 分子中的化学键形成时要释放 862 kJ 能量 C . 此反应的热化学方程式为: H 2 (g)+Cl 2 (g)=2HCl(g) Δ H = 183 kJ·mol − 1 D . 此反应的热化学方程式为: 1/2H 2 (g)+1/2Cl 2 (g)=HCl(g) Δ H =- 91.5 kJ·mol − 1 |
|
| 3. | 详细信息 |
|
在 2L 密闭容器内,某气体反应物在 2s 内由 8mol 变为 7.2mol ,则用该气体表示该反应的平均反应速率为 A . 0.4 mol·L −1 ·s −1 B . 0.3 mol·L −1 ·s −1 C . 0.2 mol·L −1 ·s −1 D . 0.1 mol·L −1 ·s −1 |
|
| 4. | 详细信息 |
|
下列叙述正确的是 A . 甲烷的燃烧热为 ΔH=-890.3kJ·mol -1 ,则甲烷燃烧的热化学方程式可表示为 CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(g) ΔH=-890.3kJ·mol -1 B . 已知 H + (aq)+OH - (aq)=H 2 O(l) ΔH=-57.3kJ·mol -1 ,则稀 H 2 SO 4 溶液和稀 Ba(OH) 2 溶液反应的反应热 ΔH=2×(-57.3)kJ·mol -1 C . CO(g) 的燃烧热是 283.0kJ/mol ,则 2CO 2 (g)=2CO(g)+O 2 (g) 反应的 ΔH=+(2×283.0)kJ/mol D . 需要加热才能发生的反应一定是吸热反应 |
|
| 5. | 详细信息 |
|
已知化学反应 2C(s) + O 2 (g) A . 12 g 碳所具有的能量一定高于 28 g CO 所具有的能量 B . 56 g CO 和 32 gO 2 所具有的总能量大于 88g CO 2 所具有的总能量 C . 12 g C 和 32 g O 2 所具有的总能量大于 44g CO 2 所具有的总能量 D . 将一定质量的 C 燃烧,生成 CO 2 比生成 CO 时放出的热量多 |
|
| 6. | 详细信息 |
|
已知在发射卫星时可用肼( N 2 H 4 )为燃料、二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。又知: ①N 2 ( g )+ 2O 2 ( g )= 2NO 2 ( g ) ΔH =+ 67 . 7kJ/mol ②N 2 H 4 ( g )+ O 2 ( g )= N 2 ( g )+ 2H 2 O ( g ) ΔH =- 534kJ/mol 则肼与 NO 2 反应的热化学方程式为 A . N 2 H 4 g )+ NO 2 ( g )= B . N 2 H 4 ( g )+ NO 2 ( g )= C . N 2 H 4 ( g )+ NO 2 ( g )= D . N 2 H 4 ( g )+ NO 2 ( g )= |
|
| 7. | 详细信息 |
|
一定条件下,在密闭恒容容器中,能表示反应 X(g)+2Y(g) ① X 、 Y 、 Z 的物质的量之比是 1 : 2 : 2 ② X 、 Y 、 Z 的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成 nmolZ ,同时生成 2nmolY A . ①② B . ①④ C . ②③ D . ③④ |
|
| 8. | 详细信息 |
|
有一处于平衡状态的反应: X(s) + 3Y(g) ①高温 ②低温③高压④低压⑤加催化剂⑥分离出 Z A . ①③⑤ B . ②③⑤ C . ②④⑥ D . ②③⑥ |
|
| 9. | 详细信息 |
|
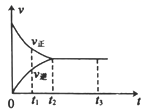
在容积可变的密闭容器中存在如下反应: CO(g)+H 2 O(g) A .图 Ⅰ 研究的是 t 0 时升高温度对反应速率的影响 B .图 Ⅱ 研究的是 t 0 时增大压强(缩小体积)或使用催化剂对反应速率的影响 C .图 Ⅲ 研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D .图 Ⅲ 研究的是温度对化学平衡的影响,且乙的温度较高 |
|
| 10. | 详细信息 | ||||||||||||
|
在 25 ℃时,密闭容器中 X 、 Y 、 Z 三种气体的初始浓度和平衡浓度如表:
下列说法错误的是 A . 反应达到平衡时, X 的转化率为 50 % B . 反应可表示为 X + 3Y C . 增大压强使平衡向生成 Z 的方向移动,平衡常数增大 D . 改变温度可以改变此反应的平衡常数 |
|||||||||||||
| 11. | 详细信息 |
|
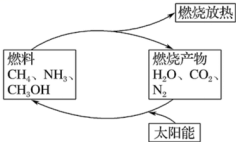
如果对燃烧产物如二氧化碳、水、氮气等利用太阳能使它们重新组合,可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为 A . 化学能 B . 热能 C . 生物质能 D . 电能 |
|
| 12. | 详细信息 |
|
下列措施是为了降低化学反应速率的是 A .食品放在冰箱中贮藏 B .工业炼钢用纯氧代替空气 C .合成氨工业中使用催化剂 D .在加热条件下,用氢气还原氧化铜 |
|
| 13. | 详细信息 |
|
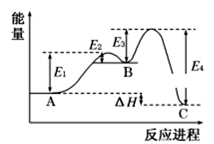
某反应由两步反应 A→B→C 构成,它的反应能量曲线如图,下列叙述正确的是( ) A . 两步反应均为吸热反应 B . A 与 C 的能量差为 E 4 C . 三种化合物中的稳定性 B ﹤ A ﹤ C D . A→B 反应,反应条件一定要加热 |
|
| 14. | 详细信息 |
|
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是 A . 反应混合物的浓度 B . 反应体系的压强 C . 正、逆反应的速率 D . 反应物的转化率 |
|
| 15. | 详细信息 |
|
在一定温度下的恒容密闭容器中,表明反应 A(s)+2B(g) A . 混合气体的压强不变 B . 混合气体的密度不变 C . 反应物的相对分子质量不变 D . 气体的总物质的量不变 |
|
| 16. | 详细信息 |
|
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: S(s)+2KNO 3 (s)+3C(s)= K 2 S(s)+ N 2 (g)+3CO 2 (g) Δ H = x kJ·mol -1 已知:碳的燃烧热 Δ H 1 = a kJ·mol -1 ; S(s)+2K(s)=K 2 S(s) △ H 2 = b kJ·mol -1 2K(s)+N 2 (g)+3O 2 (g)=2KNO 3 (s) △ H 3 = c kJ·mol -1 ;则 x 为 ( ) A . 3 a + b - c B . c -3 a - b C . a + b - c D . c - a - b |
|
| 17. | 详细信息 |
|
体积一定的绝热密闭容器中加入等物质的量的 X 、 Y ,进行如下可逆反应: X (g)+ Y (g) A .若继续充入 X ,平衡向正反应方向移动, Y 的转化率增大 B .若继续充入 Z ,平衡逆向移动, Z 的体积分数减小 C .若移走部分 W ,平衡正向移动 D .平衡后移走 X ,上述反应的 ΔH 减小 |
|
| 18. | 详细信息 |
|
下列依据热化学方程式得出的结论正确的是 A . 已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H 2 O(l) ΔH=-57.3kJ·mol -1 ,则含 1molNaOH 的稀溶液与稀醋酸完全中和,放出热量小于 57.3kJ B . 已知 2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH=-483.6kJ·mol -1 ,则氢气的燃烧热为 241.8kJ·mol -1 C . 已知 2C(s)+ O 2 (g)=2CO 2 (g) ΔH=a 2C(s)+O 2 (g)=2CO(g) ΔH=b ,则 a>b D . 已知 P( 白磷, s)=P( 红磷, s) ΔH<0 ,则白磷比红磷稳定 |
|
| 19. | 详细信息 |
|
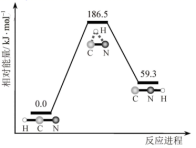
理论研究表明,在 101kPa 和 298K 下, A . HCN 比 HNC 稳定 B . 该异构化反应的 C . 正反应的活化能大于逆反应的活化能 D . 使用催化剂,可以改变反应的反应热 |
|
| 20. | 详细信息 |
|
已知: Fe 2 O 3 (s)+ C(s)+O 2 (g)=CO 2 (g) Δ H = -393.5 kJ/mol , 则 2Fe(s)+ A . -824.4 kJ/mol B . -627.6 kJ/mol C . -744.7 kJ/mol D . -169.4 kJ/mol |
|
| 21. | 详细信息 |
|
一定温度下,把 6 mol A 和 5 mol B 通入容积为 4L 的恒容密闭容器中发生反应 3A(g) + B(g) A . t 2 = 5min ,平衡时 3v 正 (A) = 2v 逆 (D) B . 0 ~ t 2 , A 的平均反应速率为 0.15 mol·L - 1 ·min - 1 C . t 2 ~ t 3 ,各物质的浓度一定相等 D . B 的平衡转化率为 25% |
|
| 22. | 详细信息 |
|
根据 下列说法正确的是: A . C . |
|
| 23. | 详细信息 |
|
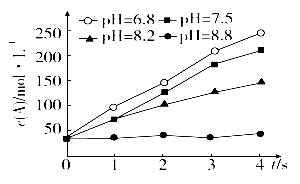
实验测得某反应在不同 pH 下产物 A 的浓度随时间变化的关系如图 ( 其他条件相同 ) 。则下列有关说法正确的是 ( ) A . 若增大压强,该反应的反应速率一定增大 B . pH=6.8 时,随着反应的进行反应速率逐渐增大 C . 一定 pH 范围内,溶液中 H + 浓度越小,反应速率越快 D . 可采用调节 pH 的方法使反应停止 |
|
| 24. | 详细信息 |
|
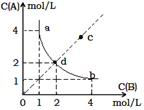
T o C 时,在一固定容积的密闭容器中发生反应: A(g)+B(g) A . T o C 时,该反应的平衡常数值为 4 B . c 点没有达到平衡,此时反应向逆向进行 C .若 c 点为平衡点,则此时容器内的温度高于 T o C D . T o C 时,在 d 点加入一定量 X 可达到 c 点 |
|
| 25. | 详细信息 |
|
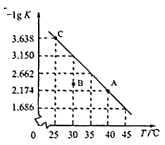
将一定量的硫化氢气体加入一密闭容器中,发生反应 2H 2 S(g)=S 2 (g)+2H 2 (g) ,该反应的平衡常数的负对数 (-lg K ) 随温度 (T) 的变化如图所示。下列说法不正确的是 A . C 点对应状态的平衡常数为 10 -3.638 B . 该反应的 Δ H >0 C . A 、 C 点的反应速率 V A >Vc D . 30 ℃时, B 点对应状态 v 正 >v 逆 |
|
| 26. | 详细信息 |
|
将 NO 2 装入带活塞的密闭容器中,当反应 2NO 2 (g) ⇌ N 2 O 4 (g) 达到平衡后,改变下列一个条件,其中叙述正确的是 A . 恒温恒压时,充入少量惰性气体,平衡向右移动,混合气体的颜色变浅 B . 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 C . 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 D . 恒温恒容时,充入少量惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
|
| 27. | 详细信息 | ||||||||
|
已知: 2CH 3 OH ( g )
A . 此时刻反应达到平衡状态 B . 容器内压强不变时,说明反应达平衡状态 C . 平衡时,再加入与起始等量的 CH 3 OH ,达新平衡后 CH 3 OH 转化率不变 D . 平衡时,反应混合物的总能量降低 40 kJ |
|||||||||
| 28. | 详细信息 |
|
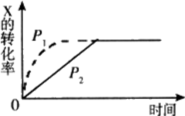
在一定温度下,向密闭容器中充入 1 mol HI 气体,建立如下平衡: 2HI(g) A . a < b B . a > b C . a = b D . 无法比较 |
|
| 29. | 详细信息 |
|
图中曲线分别表示相同温度下,压强为 P 1 、 P 2 条件下发生可逆反应: mX(g)+nY(g) A . P 1 >P 2 B . m+n=2 C . m+n=3 D . P 1 、 P 2 下平衡常数相同 |
|
| 30. | 详细信息 |
|
已知反应 2NO(g) + 2CO(g) ⇌ N 2 (g) + 2CO 2 (g) △ H <0 ,该反应自发进行的条件是 A . 低温自发 B . 高温自发 C . 任意温度下都能自发进行 D . 一定非自发 |
|
| 31. | 详细信息 |
|
把 2.5molA 和 2.5molB 通入容积为 2L 的密闭容器里,发生如下反应: 3A(g)+B(g) A . x=4 B . 达到平衡状态时容器内气体的压强与起始时压强比为 6 : 5 C . 达到平衡状态时 A 的转化率为 50% D . 5s 内 B 的反应速率 v(B)=0.05mol/(L·s) |
|
| 32. | 详细信息 |
|
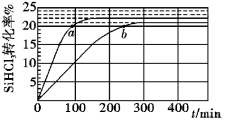
三氯氢硅 (SiHCl 3 ) 是制备硅烷、多晶硅的重要原料,对于反应 2SiHCl 3 (g) A . 该反应的正反应活化能大于逆反应活化能 B . a 、 b 处反应速率大小: v a 大于 v b C . 温度一定时使用更优质催化剂,可使 k 正 、 k 逆 增大, k 正 与 k 逆 的比值增大 D . 343K 时反应的平衡常数 K= |
|
| 33. | 详细信息 | ||||||||||
|
肼 (N 2 H 4 ) 可作为火箭发动机的燃料,与 N 2 O 4 反应生成 N 2 和水蒸气。已知: ① N 2 (g)+2O 2 (g)=N 2 O 4 (l) Δ H 1 =-19.5kJ·mol -1 ② N 2 H 4 (l)+O 2 (g)=N 2 (g)+2H 2 O(g) Δ H 2 =-534.2kJ·mol -1 (1) 写出肼和 N 2 O 4 反应的热化学方程式 _______ ; (2) 火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应: N 2 O 4 (g) ⇌ 2NO 2 (g) ①上述反应的 Δ H _______ 0( 选填 “ > ” 或 “ < ”) 。 ②保持温度和体积不变向上述平衡体系中再充入一定量的 N 2 O 4 ,再次达到平衡时,混合气体中 NO 2 的体积分数 _______ ( 填 “ 增大 ” 、 “ 减小 ” 或 “ 不变 ”) ,混合气体的颜色 _______ ( 填 “ 变深 ” 或 “ 变浅 ”) 。 ③一定温度下,将 1molN 2 O 4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是 _______ 。 ④相同温度下,上述反应改在 10L 的恒容密闭容器中进行,反应 3s 后 NO 2 的物质的量为 0.6mol ,则 0~3s 内的平均反应速率 v (N 2 O 4 )= _______ mol·L -1 ·s -1 。 (3)CO 2 与 CH 4 经催化重整,制得合成气: CH 4 (g)+CO 2 (g) ⇌ 2CO(g)+2H 2 (g) 。已知上述反应中相关的化学键键能数据如下:
则该反应的 Δ H = _______ 。 |
|||||||||||
| 34. | 详细信息 | |||||||||
|
(1)2010 年 Sheth 等得出乙炔在 Pd 表面选择加氢的反应机理 ( 如图 ) 。其中吸附在 Pd 表面上的物种用 * 标注。 上述吸附反应为 _______ ( 填 “ 放热 ” 或 “ 吸热 ”) 反应,该历程中最大能垒 ( 活化能 ) 为 _______ kJ·mol -1 ,该步骤的化学方程式为 _______ 。 (2) 已知: Fe(s)+CO 2 (g) ⇌ FeO(s)+CO(g) Δ H 1 ,平衡常数为 K 1 ; Fe(s)+H 2 O(g) ⇌ FeO(s)+H 2 (g) Δ H 2 ,平衡常数为 K 2 。 在不同温度时 K 1 、 K 2 的值如表:
反应 CO 2 (g)+H 2 (g) ⇌ CO(g)+H 2 O(g) Δ H ,平衡常数为 K ,则 Δ H = _______ ( 用 Δ H 1 和 Δ H 2 表示 ) , K = _______ ( 用 K 1 和 K 2 表示 ) ,且由上述计算可知,反应 CO 2 (g)+H 2 (g) ⇌ CO(g)+H 2 O(g) 是 _______ ( 填 “ 吸热 ” 或 “ 放热 ”) 反应。 (3) 已知化学反应 A 2 (g)+B 2 (g)=2AB(g) 的能量变化如图,请写出该反应的热化学方程式: _______ 。 |
||||||||||
| 35. | 详细信息 |
|
汽车尾气已成为城市空气的主要污染源之一,其中的氮氧化物是重要污染物。 (1) 汽车内燃机工作时产生 NO 的原理如图 1 所示: 该反应的热化学方程式为 ________________________ 。 (2) 治理尾气的方法之是在排气管上安装强化转化器,发生如下反应: 2NO(g)+2CO(g) ①则从开始到达到平衡状态的过程中,平均反应速率 v(CO 2 )= _______ ,该温度 下反应的平衡常数 K= _________ 。 ( 结果保留两位有效数字 ) ② 20 min 时改变的条件可能是 ________ 。 A .增大压强 B .升高温度 C .减小 CO 2 浓度且改用更高效的催化剂 D .在恒温恒容条件下,充入 He 气体 ③若保持温度不变, 20 min 时向容器中充入 CO 、 N 2 各 0.6 mo1 ,平衡将 ____ ( 填 “ 正向 ”“ 逆向 ” 或 “ 不 ) 移动,原因是 __________________ 。 (3) 用焦炭还原 NO 2 的反应为 2NO 2 (g) +2C(s) |
|
| 36. | 详细信息 |
|
(1) 在下列事实中,什么因素影响了化学反应的速率? ①石灰石煅烧时要粉碎成细小的矿粒 _______ ; ②熔化的 KClO 3 放出气泡很慢,撒入少量 MnO 2 ,则很快产生气体 _______ ; ③同样大小的石灰石分别在 0.1mol·L -1 的盐酸和 1mol·L -1 的盐酸中反应速率不同 _______ ; ④夏天的食品易霉变,冬天就不易发生该现象 _______ ; (2) 依据实验数据,写出下列反应的热化学方程式。 ① 1molC 2 H 4 (g) 与适量 O 2 (g) 反应,生成 CO 2 (g) 和 H 2 O(1) ,放出 1411kJ 热量 _______ 。 ② 2molAl(s) 与适量 O 2 (g) 发生反应,生成 Al 2 O 3 (s) ,放出 1669.8kJ 热量 _______ 。 ③若适量的 N 2 和 O 2 完全反应,每生成 23gNO 2 需要吸收 16.95kJ 热量,则表示该反应的热化学方程式为 _______ 。 ④在 25 ℃、 101kPa 时, 4gH 2 在足量 O 2 中完全燃烧生成 H 2 O(1) 放出 571.6kJ 的热量,则表示 H 2 燃烧热的热化学方程式为 _______ 。 |
|
| 37. | 详细信息 |
|
反应 H 2 (g)+I 2 (g) ⇌ 2HI(g) ,在一容积可变的密闭容器中进行,试回答: (1) 将容器的体积缩小一半,其正反应速率 _______ ( 填 “ 增大 ” 、 “ 不变 ” 或 “ 减小 ” ,下同 ) ,平衡 _______ 移动 ( 填 “ 不 ” 、 “ 向正反应方向 ” 或 “ 向逆反应方向 ” ,下同 ) 。 (2) 保持体积不变,充入氩气使体系压强增大,其正反应速率 _______ ,平衡 _______ 移动。 (3) 保持体积不变,充入氢气,其正反应速率 _______ ,平衡 _______ 移动。 |
|
| 38. | 详细信息 |
|
300 ℃时,将 2molA 和 2molB 两种气体混合于 2L 密闭容器中,发生如下反应 3A(g)+B(g) (1)300 ℃时,该反应的平衡常数表达式为: K= __________________ ;已知 K 300 ℃ < K 350 ℃ ,则 △ H ______ 0( 填 “ > ” 或 “ < ”) 。 (2) 在 2min 末时, B 的平衡浓度为 _____________ , D 的平均反应速率为 ____________ ; (3) 若温度不变,缩小容器容积,则 A 的转化率 ___________ ( 填 “ 增大 ” 、 “ 减小 ” 或 “ 不变 ”) ,原因是 ___________ ; |
|
| 39. | 详细信息 | ||||||||||||||||||
|
I. 在水溶液中橙色的 (1) 向上述溶液中加入 NaOH 溶液,溶液呈 _______ 色。因为 _______ 。 (2) 向上述溶液中加入较浓硫酸,则溶液呈 _______ 色,因为 _______ 。 II.KI 溶液在酸性条件下能被氧气氧化为 I 2. 现有以下实验记录,回答:
(1) 该实验的目的是 _______ 。 (2) 实验试剂除了 1mol/LKI 溶液、 0.1mol/LH 2 SO 4 溶液外,还需要的试剂是 _______ 。 (3) 由上述实验记录可得出的结论是 _______ 。 |
|||||||||||||||||||