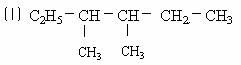2016高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
通常用来衡量一个国家的石油化学工业发展水平的标志是 ( ) A.石油产量 B.乙烯的产量 C.合成纤维的产量 D.硫酸的产量
|
|
| 2. | 详细信息 |
|
下列有机物在常温下呈液态的是 ( ) A.CH3(CH2)3CH3 B.CH3(CH2)16CH3 C.CH3CH3 D.CH3Cl
|
|
| 3. | 详细信息 |
|
下列物质不能使酸性高锰酸钾溶液褪色的是 A.SO2 B.苯 C.乙烯 D.乙醇
|
|
| 4. | 详细信息 |
|
下列各组液体混合物,能用分液漏斗分离的是 A.乙酸和水 B.液溴和苯 C.苯和水 D.乙醇和水
|
|
| 5. | 详细信息 |
|
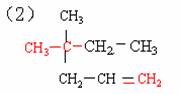
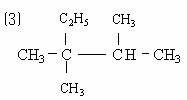
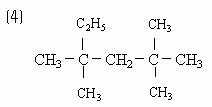
下列各组物质中,属于同系物的是 ( )
A.⑴ ⑶ B.⑴ ⑷ C.⑵ ⑶ D.⑵ ⑷
|
|
| 6. | 详细信息 |
|
氟里昂(CCl2F2 :二氟二氯甲烷)是常用的制冷剂,但近年的研究表明,它会破坏臭气层。现科学家研究出它的一种替代品:CH2F2(二氟甲烷),关于二氟甲烷的叙述不正确的是 A.它可能是甲烷与氟气发生取代的产物 B.它有两种同分异构体 C.它属于烃的衍生物 D.它不存在同分异构现象
|
|
| 7. | 详细信息 |
|
下列反应中,属于取代反应的是 ( ) A. 乙烯在空气中燃烧 B. 乙烷在空气中燃烧 C. 乙烯使氯水褪色 D. 乙烷与氯气在光照下颜色变浅
|
|
| 8. | 详细信息 |
|
交通警察检查司机是否酒后驾车的方法是让司机呼出的气体接触强氧化剂重铬酸钾,通过重铬酸钾颜色的变化来判断是否酒后驾车。如果司机是酒后驾车,则酒精在仪器中发生了 ( ) A.氧化反应 B.还原反应 C.消去反应 D.酯化反应
|
|
| 9. | 详细信息 |
|
某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是 A. S B. C C.Si D. Cl
|
|
| 10. | 详细信息 |
|
在2L密闭容器中,在一定条件下发生A+3B A.0.04mol/(L.s) B.0.08mol/(L.s) C.0.4mol/(L.s) D.0.8mol/(L.s)
|
|
| 11. | 详细信息 |
|
决定化学反应速率的主要因素是 A.参加反应的物质本身的性质 B.催化剂 C.温度、压强以及反应物的接触面 D.反应物的浓度
|
|
| 12. | 详细信息 |
|
用铁片与稀硫酸反应制取氢气时,下列的措施中,不能使氢气生成速率加快的是 A. 加热 B. 不用稀硫酸,改用98﹪浓硫酸 C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
|
|
| 13. | 详细信息 |
|
已知空气—锌电池的电极反应为:锌片:Zn+2OH――2e-=ZnO+H2O; 碳棒: A.正极,被还原 B.正极,被氧化 C.负极,被还原 D.负极,被氧化
|
|
| 14. | 详细信息 |
|
下列各图中,表示正反应是吸热反应过程的能量变化图是
|
|
| 15. | 详细信息 |
|
下列说法不正确的是 A.钠在氧气中燃烧生成淡黄色的固体Na2O2,可做为呼吸面具的供氧剂 B.液氯是氯气的水溶液,它能使干燥的有色布条褪色 C.氯气能与大多数金属化合,生成金属氯化物(盐) D.氯水具有杀菌、漂白作用是因氯水中含有强氧化性的次氯酸
|
|
| 16. | 详细信息 |
|
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。 结合有关知识,回答下列问题: (1)乙醇分子中的官能团是__________。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙醇汽油的好处是(写出一条即可)_____________________________。 (4)对于司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下: 2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O
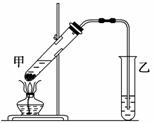
(5)在实验室里我们可以用乙醇按如图所示的装置来制取乙酸乙酯,乙中所盛的试剂为____________,该反应方程式是_________________________________; 该装置图中有一个明显的错误是_________________________。
|
|
| 17. | 详细信息 |
|
(11分)现有如下两个反应: (A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2 (1)根据两反应本质,分别判断能否用于设计原电池____________________________。 (2)如果不能,说明其原因__________________________________________________。
和正负极材料,标出电子流动方向和电流方向,写出电极反 应式。 ________是正极,正极反应式:___________________; ________是负极,负极反应式:__________________。
|
|
| 18. | 详细信息 |
|
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上电子数之和。 (1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。 (2)写出A、B的化合物与E反应的化学方程式: 。 (3)A、B两元素形成化合物属 (“离子”或“共价”)化合物。 (4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
|
|
| 19. | 详细信息 |
|
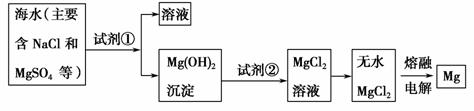
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应________________。 (2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是__________________________。 (3)试剂②选用________;写出其反应的离子方程式 ________________________________________________________________________。 (4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________________________________________________________________________。
|
|