2019福建高二下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
化学与生产和生活密切相关。下列有关说法正确的是() A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 B. 中国天眼FAST用到的碳化硅是一种新型的有机高分子材料 C. 第五形态 D. 压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的清洁燃料
|
|
| 2. | 详细信息 |
|
下列反应中前者属于取代反应,后者属于加成反应的是 A. 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 B. 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 C. 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 D. 乙烯与溴水反应;乙酸与乙醇的酯化反应
|
|
| 3. | 详细信息 |
|
下列化学用语表示正确的是() A. 四氯化碳分子的比例模型: C. CH3CH2NO2与H2NCH2COOH互为同分异构体 D. 丙烯的键线式:
|
|
| 4. | 详细信息 |
|
下列对有机物结构的叙述中不正确的是( ) A. 乙烯、溴苯分子中的所有原子均共平面 B. 在有机物分子中,含有的氢原子个数一定是偶数 C. D. CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构
|
|
| 5. | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列说法中正确的是() A. 标准状况下,22.4LCCl4含有的分子数为NA B. 1.0mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA C. 在含4mol Si-O键的二氧化硅晶体中,氧原子的数目为2NA D. 46g有机物C2H6O的分子结构中含有的C—H键数目一定为5NA
|
|
| 6. | 详细信息 |
|
.2018年8月22日,国务院总理李克强主持召开国务院常务会议,会议决定扩大车用乙醇汽油的推广和使用,除原有的11个试点省份外,进一步在北京等15个省市推广。下列关于“乙醇汽油”的说法正确的有() ①“乙醇汽油”是在汽油里加入适量乙醇混合而成的一种燃料,它是一种新型化合物 ②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成二氧化碳和水 ③“乙醇汽油”的使用可有效减少汽车尾气中的碳排放、细颗粒物排放以及其他有害物质的污染 ④石油的分馏、裂化和煤的干馏都是化学变化 ⑤煤油可由石油裂解获得,可用作燃料和保存少量金属钠 ⑥“地沟油”危害人体健康,可通过蒸馏“地沟油”的方式获得汽油和柴油,实现资源的再利用 A. ①⑤ B. ③ C. ②③ D. ⑥
|
|
| 7. | 详细信息 |
|
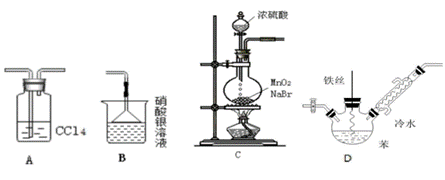
某化学小组欲利用如图所示的实验装罝探究苯与液溴的反应。已知:MnO2+2NaBr+2H2SO4
A. 装置A的作用是除去HBr中的溴蒸气 B. 装置B的作用是检验Br − C. 可以用装置C制取溴气 D. 待装置D反应一段时间后抽出铁丝反应会终止
|
|
| 8. | 详细信息 |
|
.由于电影《我不是药神》中对抗癌药物格列卫的关注,我国政府在2018年已经将格列卫等部分抗癌药物纳入医保用药,解决了人民群众用药负担。格列卫在其合成过程中的一种中间产物结构表示如下: A. 该药物中间体属于芳香烃 B. 该药物中间体中含有三种官能团 C. 该药物中间体的所有碳原子可能共面 D. 该药物中间体可以发生加成反应和取代反应
|
|
| 9. | 详细信息 |
|
某有机物其结构简式为 A. 分子式为C13H18Cl B. 该分子中能通过聚合反应生成高分子化合物 C. 在加热和催化剂作用下,最多能和3mol H2反应 D. 能使酸性KMnO4溶液褪色,但不能使溴水褪色
|
|
| 10. | 详细信息 |
|
实现下列变化时,需克服相同类型作用力的是( ) A. 二氧化硅和干冰的熔化 B. 食盐和葡萄糖分别溶解在水中 C. 锌和氯化铵的熔化 D. 液氯和苯的汽化
|
|
| 11. | 详细信息 |
|
根据元素周期表和元素周期律,判断下列叙述正确是( ) A. 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 B. 氢元素与其他元素可形成共价化合物或离子化合物 C. 图所示实验可证明元素的非金属性强弱Cl>C>Si
D. 同主族元素上到下,单质的熔点逐渐升高
|
|
| 12. | 详细信息 |
|
三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟气(F2)在一定条件下直接反应得到的。4NH3 +3F2==NF3+ 3NH4F。下列关于三氟化氮的叙述,正确的是( ) A. NF3中的N呈-3价 B. 电负性由大到小的顺序:H>N>F C. NF3可能是一种极性分子 D. NF3和NH4F都
|
|
| 13. | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Z是地壳中含量最高的元素,W是同周期原子半径最大的金属元素。下列说法正确的是() A. Z的简单气态氢化物的热稳定性比Y的强 B. 原子半径的大小顺序:r(W)>r(Z)>r(Y) C. X的最高价氧化物对应水化物的酸性比Y的强 D. Z分别与X、W形成的化合物的化学键类型相同
|
|
| 14. | 详细信息 | ||||||
|
X、Y、Z、W是原子序数依次增大的短周期主族元素,部分元素在周期表中的位置如下图所示,其中X、Y、W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物均能发生反应,下列说法中不正确的是()
A. 简单离子半径大小关系为:Y>Z>W B. X与Y可以存在于同一离子化合物中 C. Z、W氧化物的熔点高低:Z<W D. X与氢元素形成的化合物中,只含极性键
|
|||||||
| 15. | 详细信息 |
|
寿山石{X4[Y4Z10](ZW)8}的组成元素均为短周期元素,X的最高价氧化物对应水化物常用于治疗胃酸过多,X的简单离子与ZW-含有相同的电子数,Y的单质是制造芯片的基础材料。下列说法正确的是() A. 原子半径:Y>X >Z>W B. 最高价氧化物水化物的酸性:X >Y C. NaW与水反应时作还原剂 D. 简单氢化物的热稳定性:Y>Z
|
|
| 16. | 详细信息 |
|
.短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中 A. 氢化物的沸点:W<X B. 简单离子半径:X>Y>Z C. 化合物P中既含有离子键又含有共价键 D. W、X、Y三种元素形成的物质的水溶液显碱性
|
|
| 17. | 详细信息 |
|
如图,是实验室制备乙酸乙酯的装置。a试管中加入3 mL 95%的乙醇、2 mL 浓硫酸、2 mL 冰醋酸;b试管中是饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
(1)在a试管中除了加入乙醇、浓硫酸和乙酸外,还应放入____________,目的是____________。 (2)试管b中观察到的主要现象是__________________________。 (3)实验中球形干燥管除起冷凝作用外,另一个重要作用是_________________。 (4)饱和Na2CO3溶液的作用是__________________________________________。 (5)反应结束后,将试管中收集到的产品倒入分液漏斗中,然后分液,得到乙酸乙酯。
|
|
| 18. | 详细信息 |
|
铁及其化合物与人类生产、生活息息相关。 (1)FeCl3可用作止血剂。基态铁原子的核外电子排布式为______, Fe3+有______个未成对电子。 (2)K3[Fe(CN)6]主要应用于照相纸、颜料、制革、印刷等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。 ①K3[Fe(CN)6]中所涉及的元素的第一电离能由大到小的顺序_________。 ②(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_________。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为________。 (3)CO能与金属Fe所形成的配合物Fe(CO)5,其熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:
①Fe(CO)5晶体类型属于__________晶体。 ②关于Fe(CO)5,下列说法正确的是_________。 A Fe(CO)5是非极性分子,CO是极性分子 B Fe(CO)5中Fe原子以sp3杂化方式与CO成键 C 1mol Fe(CO)5含有10mol配位键 D 反应Fe(CO)5 = Fe+5CO没有新化学键生成 (4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示:
则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________g·cm-3(用含a和NA的式子表示)。
|
|
| 19. | 详细信息 |
|
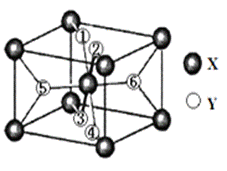
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。 (1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac +CO+NH3 ①写出铜原子的价电子轨道表示式_________。 ②氨分子的空间构型为_________;氨气极易溶于水是因为_________;氨水中各元素原子的电负性从大到小排列顺序为_________。 ③醋酸分子中,碳原子的杂化方式是___________。 ④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________。 a 离子键b 配位键c σ键d π键 (2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
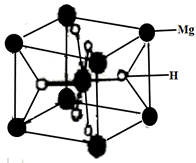
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”) ②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______。 a XY2晶体>硅烷晶体>固态氨 b XY2晶体>固态氨>硅烷晶体 c 固态氨>硅烷晶体>XY2晶体 d 硅烷晶体>固态氨>XY2晶体 (3)MgH2是金属氢化物储氢材料,其晶胞如下图所示,该晶体的密度为ag•cm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
|
|
| 20. | 详细信息 | ||||||||
|
今年是俄罗斯化学家门捷列夫提出“元素周期律”150周年。门捷列夫为好几种当时尚未发现的元素(如“类铝”“类硅”和“类硼”)留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,其性质也是和预言中的惊人相似。请回答下列问题: (1)①基态镓原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形;门捷列夫预言的“类硼”就是现在的钪,“类硅”即是现在的锗。在镓、钪、锗三种元素的原子中,未成对电子数最多的是_________ (填元素符号)。 ②下列说法中,最有可能正确的一项是_________(填字母代号)。 A 类铝在100℃时蒸气压很高 B 类铝的氧化物一定不能溶于强碱溶液 C 类铝一定不能与沸水反应 D 类铝能生成类似明矾的矾类 (2)氯化镓晶体熔点为77.9℃。氯化镓分子中镓的杂化方式为_______,空间构型为_______;写出与氯化镓互为等电子的的分子、离子各一种:_______、_______。 (3)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,GaN、GaP、GaAs晶体的熔点如下表所示,分析其变化原因:__________________。
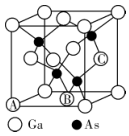
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如下图所示:
①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、B( ②若砷和镓的原子半径分别为a cm和b cm,砷化镓的摩尔质量为M g/mol,密度为
|
|||||||||
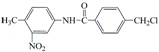 。下列有关该中间产物的说法不正确的是()
。下列有关该中间产物的说法不正确的是()