2019高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
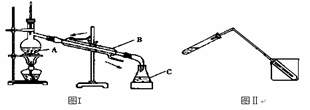
下列制取蒸馏水的实验装置与操作的说法中,不正确的是 A.温度计的水银球应插入蒸馏烧瓶中的自来水中 B.冷凝管中的水流方向是从下口进入,上口排出 C.实验中需要在蒸馏烧瓶中加入几粒 D.加热蒸馏烧瓶必须垫石棉网
|
|
| 2. | 详细信息 |
|
食盐、食醋、纯碱(Na2CO3)均为家庭厨房中常用物质,利用这些物质不能完成的实验是 A.鉴别AgNO3溶液和BaCl2溶液 B.检验鸡蛋壳(CaCO3)能否溶于酸 C.除去热水瓶内壁上的水垢 D.检验自来水中是否含Cl-
|
|
| 3. | 详细信息 |
|
古文献中记载提取硝酸钾的方法是“此即地霜也。所在山泽、冬月地上有霜、扫取水淋汁、后煎炼而成”。该文献涉及的混合物分离方法是 A.萃取 B.蒸馏 C.结晶 D.升华
|
|
| 4. | 详细信息 |
|
配制250mL 0.1mol·L−1的盐酸时,下列实验操作使所配溶液浓度偏大的是 A.用量筒量取所需的浓盐酸时俯视刻度线 B.定容时仰视刻度线 C.用量筒量取所需浓盐酸倒入烧杯后,用水洗涤量筒2~3次,洗涤液倒入烧杯中 D.定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补加几滴蒸馏水
|
|
| 5. | 详细信息 |
|
草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中.下列有关判断不正确的是 A.45g草酸中含有1.204×1024个氧原子 B.1mol草酸中含有6.02×1023个分子 C.草酸的摩尔质量是90g·mol-1 D.1mol草酸在标准状况下的体积约为22.4L
|
|
| 6. | 详细信息 |
|
下列叙述正确的是 A.1mol H2O的质量为18g B.摩尔是表示物质微粒数目的一个物理量 C.3.01×1023个SO2分子的质量为64g D.标准状况下,1mol任何物质体积均约为22.4L
|
|
| 7. | 详细信息 |
|
容量瓶上需标有以下五项中的①温度;②浓度;③容量;④压强;⑤刻度线 A.①③⑤ B.②③⑤ C.①②③ D.②③④
|
|
| 8. | 详细信息 |
|
下列溶液中Cl-浓度由大到小的顺序是 ①20mL 0.3mol·L−1 MgCl2溶液;②30mL 0.5mol·L−1 NaCl溶液;③40mL 0.5mol·L−1KClO3溶液;④10mL 0.4mol·L−1 AlCl3溶液 A.③②①④ B.①④②③ C.④①②③ D.②③①④
|
|
| 9. | 详细信息 |
|
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓 ①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②有些固体溶解会放热,若未经冷却即转移至容量瓶 ③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ④转移溶液前容量瓶内有少量蒸馏水 ⑤定容时,仰视容量瓶的刻度线 ⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 A.①③⑤⑥ B.①②⑤⑥ C. ②③④⑥ D.③④⑤⑥
|
|
| 10. | 详细信息 |
|
在下列条件下,两种气体的分子数一定相等的是 A.同密度、同压强的氮气和乙烯 B.同温度、同体积的氧气和氮气 C.同体积、同密度的乙烯和一氧化碳 D.同压强、同体积的氧气和氮气
|
|
| 11. | 详细信息 |
|
同温同压下,向两个体积可变的密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是 A.两种气体的密度之比是3∶2 B.两个容器的体积之比为2∶3 C.两种气体的分子数目相等 D.两气体的
|
|
| 12. | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法中正确的是 A.5.6g铁与足量盐酸反应转移的电子数为0.3NA B.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA C.标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA D.18g NH
|
|
| 13. | 详细信息 |
|
下列叙述中正确的是 ①标准状况下,1L HCl和1LH2O的物质的量相同; ②标准状况下,11.2L H2和14g N2所含原子数相同; ③28g CO的体积约为22.4L; ④两种物质的物质的量相同,则它们在标准状况下的体积相同; ⑤同温同体积时,气体物 ⑥同温同压下,气体的密度与气体的相对分子质量成正比。 A.⑤⑥ B.②③⑤⑥ C.②⑤⑥ D.①②④⑤⑥
|
|
| 14. | 详细信息 |
|
将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L−1NaOH溶液150mL。原硫酸溶液的浓度是 A.0.5mol·L−1 B.1mol·L−1 C.1.5mol·L−1 D.2mol·L−1
|
|
| 15. | 详细信息 |
|
标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g·mL-1,质量分数为ω,物质浓度为c mol·L−1,则下列关系中正确的是 A. c=
|
|
| 16. | 详细信息 |
|
有硫酸镁溶液500mL,它的密度是1.20g·cm−3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是 A.溶质的质量分数是24% B.溶液的物质的量浓度是2.4mol·L−1 C.溶质和溶剂的物质的量之比约为1∶21.1 D.硫酸根离子的质量是230.4g
|
|
| 17. | 详细信息 |
|
(1)氯原子的结构示意图为_____________________。 (2) (3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。 (4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO
|
|
| 18. | 详细信息 |
|
蒸馏是实验室制备蒸馏水的常用方法,如图所示的两个装置都可以制取蒸馏水。
(1)图I是实验室制取蒸馏水的常用装置,仪器A的名称是________________,加热A时要加垫石棉网,目的是_______________。 (2)水的流向是否正确?________(填“正确”或“不正确”) (3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是____________。 (4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是________________。
|
|
| 19. | 详细信息 |
|
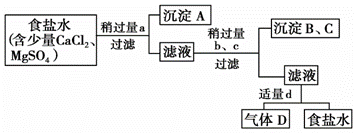
从海水得到的粗食盐水中常含Ca2+、Mg2+、SO
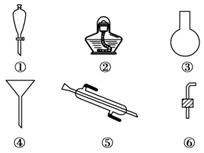
图中a、b、c、d分别表示上述4种试剂中的一种,请回答: (1)沉淀A的名称是________。 (2)试剂d是________;判断试剂d已经足量的方法是___________________________________。 (3)加入b、c后溶液中发生的化学反应的化学方程式有__________________________ ________________________________________________________ (任写两个)。 (4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是________________________。
|
|
| 20. | 详细信息 |
|
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
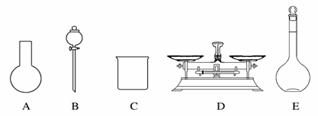
(1)该“84消毒液”的物质的量浓度约为________ mol·L−1(计算结果保留 2位有效数字)。 (2)某同学取 100mL 该“84消毒液” ,稀释后用于消毒,稀释后的溶液中 c(Na+)=_______ mol·L−1(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制 480mL含NaClO质量分数为25%的消毒液。下列说 A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 B. 将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶并加水至刻度线 C. 定容时俯视容量瓶刻度线会导致所配溶液浓度偏高 D.需要称量 NaCl 固体的质量为 143.0g
(4)该同学对容量瓶及其使用方法的认识中正确的是________ A.容量瓶上标有容积、温度和浓度 B.容量瓶用蒸馏水洗净后, 需要烘干后再使用 C.配制溶液过程中,容量瓶内液体只需要一次摇匀过程 D.使用前要检查容量瓶是否漏水 (5)“84消毒液”与稀硫酸混合使用可增强消毒能力, ①所配制的稀硫酸中,H+的物质的量浓度为_______ mol·L−1。 ②需用浓硫酸的体积为_______mL。
|
|
| 21. | 详细信息 |
|
取1.43g Na2CO3·10H2O溶于水配成100ml溶液,求: (1)Na2CO3物质的量浓度 (2)Na+物质的量浓度 (3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol·L−1,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
|
|