2020陕西高二上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
全球变暖给我们敲响了警钟,地球正面临巨大的挑战。下列说法不正确的是 A. 推广“低碳经济”,减少温室气体的排放 B. 推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展 C. 推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 D. 利用晶体硅制作的太阳能电池将太阳能直接转化为电能
|
|
| 2. | 详细信息 |
|
已知热化学方程式:SO2(g)+1/2O2(g) A. 196.64 kJ B. 98.32 kJ C. <196.64 kJ D. >196.64 kJ
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A. 物质的溶解性为难溶,则该物质不溶于水 B. 不溶于水的物质溶解度为0 C. 绝对不溶解的物质是不存在的 D. 某离子被沉淀完全是指该离子在溶液中的浓度为0
|
|
| 4. | 详细信息 |
|
用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是 A. 加热 B. 不用铁片,改用铁粉 C. 滴加少量的CuSO4溶液 D. 不用稀硫酸,改用98%浓硫酸
|
|
| 5. | 详细信息 |
|
下列各反应的化学方程式中,属于水解反应的是( ) A. H2O+ H2O B. CO2+H2O C. HCO3-+OH- D. CO32-+ H2O
|
|
| 6. | 详细信息 |
|
化学电池可以直接将化学能转化为电能,化学电池的本质是 A. 化合价的升降 B. 电子的转移 C. 氧化还原反应 D. 电能的储存
|
|
| 7. | 详细信息 |
|
在2mL NaCl溶液中加入1滴AgNO3溶液,有白色沉淀生成;再加入1滴KI溶液,沉淀转化为黄色,然后再加入1滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶解度由大到小的顺序正确的是 A. Ag2S 、 AgI 、 AgCl B. AgCl 、 AgI 、 Ag2S C. AgI 、 AgCl、 Ag2S D. AgCl 、 Ag2S 、 AgI
|
|
| 8. | 详细信息 |
|
在配制Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的 A. NaOH B. H2SO4 C. KCl D. CH3COOH
|
|
| 9. | 详细信息 |
|
相同温度下等物质的量浓度的下列溶液中,NH4+浓度最大的是( ) A. NH4HSO4 B. NH4HCO3 C. NH4Cl D. NH4HSO3
|
|
| 10. | 详细信息 |
|
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是 ( ) A. AgCl>AgI> Ag2CrO4 B. AgCl> Ag2CrO4>AgI C. Ag2CrO4>AgI>AgCl D. Ag2CrO4>AgCl>AgI
|
|
| 11. | 详细信息 |
|
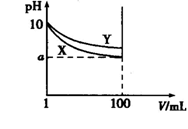
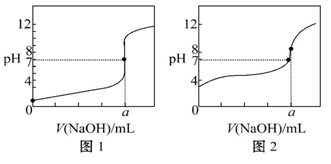
常温下,pH=10 的 X、Y 两种碱溶液各 1 mL,分别稀释至 100 mL,其 pH 与溶液体 积(V)的关系如图所示,下列说法正确的是( )
A. 若 8<a<10,则 X、Y 都是弱碱 B. X、Y 两种碱溶液中溶质的物质的量浓度一定相等 C. 稀释后,X 溶液的碱性比 Y 溶液的碱性强 D. 分别完全中和 X、Y 这两种碱溶液时,消耗同浓度盐酸的体积 Vx>Vy
|
|
| 12. | 详细信息 |
|
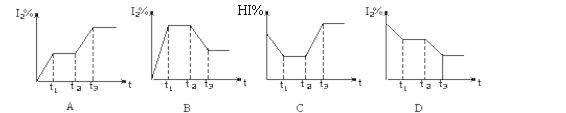
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
|
|
| 13. | 详细信息 |
|
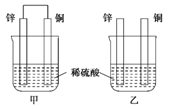
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极 C. 两烧杯中溶液的pH均增大 D. 产生气泡的速度甲比乙慢
|
|
| 14. | 详细信息 | |||||||||||||||
|
某原电池总反应为Cu+2Fe3+=Cu2++2Fe2+,下列能实现该反应的原电池是
A. A B. B C. C D. D
|
||||||||||||||||
| 15. | 详细信息 |
|
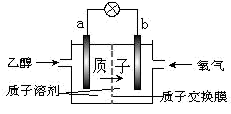
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在 200℃左右时供电( 如 下 图 所 示 ), 比 甲 醇 电 池 效 率 高 出 32 倍 , 且 比 较 安 全 。 电 池 总 反 应 为C2H5OH+3O2==2CO2+3H2O。则下列说法正确的是( )
A. a 极为电池的正极 B. 电池正极的电极反应:O2 + 4H+ + 4e- = 2H2O C. 电池工作时电子由 b 极沿导线经灯泡再到 a 极 D. 溶液中 H+ 向 a 电极移动
|
|
| 16. | 详细信息 |
|
常温下,盐酸与氨水混合后,所得溶液 pH=7,则此溶液中存在( ) A. 该溶液的溶质为 NH4Cl B. c(NH4+)+c(NH3·H2O)= c(Cl- ) C. c(NH4+)< c(Cl- ) D. c(NH4+ )+ c(OH-)=c(Cl- )+ c(H+)
|
|
| 17. | 详细信息 |
|
现有常温条件下甲、乙、丙三种溶液,甲为 0.1 mol·L-1 的 NaOH 溶液, 乙为 0.1 mol·L-1 的 HCl 溶液,丙为 0.1 mol·L-1 的 CH3COOH 溶液,试回答下列问题: (1)甲溶液的 pH=_____。 (2)丙溶液中存在的电离平衡为_____(用电离方程式表示)。 (3)甲、乙、丙三种溶液中由水电离出的 c(OH-)的大小关系为 _____。 A. 甲=乙=丙 B. 甲=乙>丙 C.甲=乙<丙 D.无法判断 (4)某同学用甲溶液分别滴定 20.00 mL 乙溶液和 20.00 mL 丙溶液,得到如图所示两 条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是_____(填“图 1”或“图 2”); ②a=_____mL。 (5)将等体积的甲溶液和丙溶液混合后,溶液呈_____(填“酸性”、“中性”或 “碱性”)。溶液中离子浓度大小顺序为_________。
|
|
| 18. | 详细信息 | ||||||||||||||||||
|
已知下列物质在 20 ℃下的 Ksp 如下,试回答下列问题:
(1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是_______(用化学式表示)。 (2)向等浓度的 KCl 和 KBr 的混合溶液中逐渐加入 AgNO3 溶液,当两种沉淀共存时, (3)测定水中 Cl-含量时,常用 Ag+进行滴定,滴定时,应加入的指示剂是_____。 A.KBr B.KI C.K2S D.K2CrO4
|
|||||||||||||||||||
| 19. | 详细信息 |
|
常温下有四种溶液:①NaHSO3、②NaHCO3、③FeCl2、④NaOH (1)上述溶液中,不能发生水解的是_____(填序号)。 (2)写出①溶液中的物料守恒关系_________________。 (3)写出②溶液中的电荷守恒关系_________________。 (4)对③的溶液加热蒸干、灼烧后,最终得到的物质为_____(填化学式),配置③溶 液时需要加稍过量铁粉,其目的是______________;还需要 加稍过量的盐酸,其目的是_____________。 (5)pH 均为 10 的②和④溶液中由水电离出的 OH-的浓度分别为_____和_____。
|
|
| 20. | 详细信息 |
|
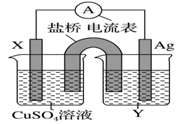
I.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
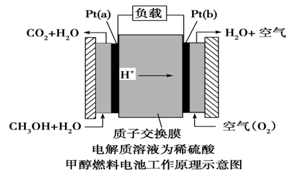
请回答下列问题: (1)电极 X 的材料是__________填化学式);电解质溶液 Y 是______填化学式)。 (2)银电极发生______填“氧化”或“还原”)反应,其电极反应式为_________;X 电极反应式为_____。 II. 高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放 电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 请回答下列问题: (1)已知放电时负极反应为 Zn-2e-+2OH- ===Zn(OH)2,则正极反应 为_____________。 (2)放电时,_____(填“正”或“负”)极附近溶液的 pH 升高。 (3)高铁电池充电时,电池的负极与电源的_____(填“正极”或“负极”),充 电时与电池负极相连的电极反应为__________。 III.近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和 水分子通过。其工作原理的示意图如下:
请回答下列问题: (1)该燃料电池的总反应为_________。 (2)Pt(a)电极是电池的_____(填“正”或“负”)极,电极反应式为:__________; Pt(b)电极反应式为___________。
|
|