2018辽宁高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
2016年1月5日,江西省国土资源厅宣布,该省地质工作者在浮梁县发现超大型钨铜矿。下列有关 A.它们是钨的三种元素 B.它们互为同位素 C.
|
|
| 2. | 详细信息 |
|
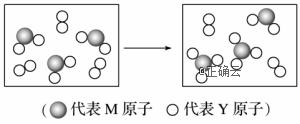
1934年居里夫妇用α粒子(4He)轰击27Al 得到一种自然界不存在的磷元素的一种同位素( A.该变化说明原子核在一般的化学反应中也能发生变化 B.该变化同样遵循质量守恒定律 C. D.对于
|
|
| 3. | 详细信息 |
|
下列说法正确的是 A. 形成离子键的阴阳离子间只存在静电吸引力 B. HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 C. 第三周期非金属元素含氧酸的酸性从左到右依次增强 D. 元素周期律是元素原子核外电子排布周期性变化的结果
|
|
| 4. | 详细信息 | ||||||||||
|
已知下列元素的半径为:
根据以上数据,磷原子的半径可能是 A.1.10×10-10m B.0.80×10-10m C.1.20×10-10m D.0.70×10-10m
|
|||||||||||
| 5. | 详细信息 |
|
X、Y是元素周期表中ⅦA族的两种元素。下列叙述能说明X的非金属性比Y强的是 A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物的沸点低 C.Y的单质能将X从NaX的溶液中置换出来 D.X的气态氢化物比Y的气态氢化物稳定
|
|
| 6. | 详细信息 |
|
从宏观方面看物质是由元素组成的,从微观方面看物质是由粒子构成的。下列有关说法不正确的是 B.元素的化学性质主要取决于元素原子的最外层电子数 C.只由一种分子构成的物质一定是纯净物 D.质子数等于电子数的微粒,可能是一种分子和一种离子
|
|
| 7. | 详细信息 |
|
下列叙述中金属M的活泼性肯定比金属N活泼性强的是 A.M原子的最外层电子数比N原子的最外层电子数少 B.常温时,M能从水中置换出氢,而N不能 C.1 mol M从酸中置换H+生成的H2比1 mol N从酸中置换H+生成的H2多 D.M的氧化物对应水化物的碱性比N的氧化物对应水化物的碱性强
|
|
| 8. | 详细信息 |
|
下列化学用语的使用正确的是 A.Mg2+的结构示意图: B.氚的原子符号: C.MgCl2的形成: D.Cl2的电子式:Cl
|
|
| 9. | 详细信息 |
|
A、B、C、D、E五种同一周期的主族元素,A和B的最高价氧化物对应水化物呈碱性,且碱性:B>A;C和D的最高价氧化物对应水化物呈酸性,且酸性C>D;E是五种元素中原子半径最小的元素。则它们的原子序数由小到大的顺序是 A.A、B、C、D、E B.E、C、D、B、A C.B、A、D、C、E D.C、D、A、B、E
|
|
| 10. | 详细信息 |
|
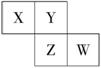
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的 A.阴离子的半径从大到小排列顺序为:X>Y>Z>W B.X、Y、Z、W元素的氢化物分子间都可以形成氢键 C.Y的两种同素异形体在常温下可以相互转化 D.最高价氧化物对应的水化物的酸性:W>Z
|
|
| 11. | 详细信息 |
|
关于含正离子N A.N B.N C.化合物N5AsF6中As的化合价为+1价 D.化合物N5AsF6中F的化合价为-1价
|
|
| 12. | 详细信息 |
|
关于氢键,下列说法不正确的是 A.HF的沸点比HCl的沸点高,是由于HF分子间存在氢键 B.水结成冰时体积膨胀,是由于水分子之间形成更多的氢键 C.NH3的稳定性很强,是因为其分子间能形成氢键 D.在氨水中,水分子和氨分子之间也存在氢键
|
|
| 13. | 详细信息 |
|
“神舟六号”所用动力燃料之一为氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,有关下列叙述中正确的是 A.等物质的量的三种物质质子数之比为1∶2∶3 B.等物质的量的三种物质中子数之比为1∶1∶1 C.等物质的量的三种物质的摩尔质量之比为8∶9∶10 D.三种物质的化学性质不相同
|
|
| 14. | 详细信息 |
|
某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断 A.R一定是第四周期元素 B.R一定是ⅣA族元素 C.R的气态氢化物比同周期其他元素气态氢化物稳定 D.R气态氢化物化学式为H2R
|
|
| 15. | 详细信息 |
|
下列关于元素周期表和元素周期律的说法错误的是 A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 B.第二周期元素从Li到F,非金属性逐渐增强 C.因为Na比K容易失去电子,所以Na比K的还原性强 D.O与S为同主族元素,且O比S的非金属性强
|
|
| 16. | 详细信息 |
|
下列关于NaHSO4的说法中正确的是 A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电 B.NaHSO4固体中阳离子和阴离子的个数比是2∶1 C.NaHSO4固体熔化时破坏的是离子键和共价键 D.NaHSO4固体溶于水时破坏的是离子键和共价键
|
|
| 17. | 详细信息 |
|
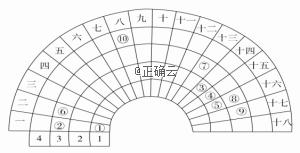
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是 A.②⑧⑨对应简单离子半径依次减小 B.⑥的氯化物的熔点比⑦的氯化物熔点低 C.元素⑩处于常见周期表第四周期ⅧB族 D.①分别与③④⑤均可形成既含极性键又含非极性键的化合物
|
|
| 18. | 详细信息 |
|
据新浪科技网报道:美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这很可能是21世纪人类最伟大的发现之一,将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含元素之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是 A.离子键 B.共价键 C.一种静电引力 D.一种静电斥力
|
|
| 19. | 详细信息 |
|
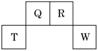
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。下列说法正确的是 A. B.离子半径的大小顺序为:r(Tm+)>r(Wn-) C.元素Q的氧化物均为酸性氧化物 D.元素T与元素R的最高正价之和等于8
|
|
| 20. | 详细信息 |
|
已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为 A.
|
|
| 21. | 详细信息 |
|
可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子的结构和性质的判断,错误的是 ①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价 ⑦“类钫”单质的密度大于1 g·cm-3 ⑧“类钫”的单质有较高的熔点 A.①②④⑧ B.①②③⑦ C.③④⑤⑧ D.①③④⑦
|
|
| 22. | 详细信息 |
|
X和Y是短周期元素,二者能形成化合物X2Y3,若Y的原子序数为n,则X的原子序数不可能是 A.n-8 B.n-3 C.n-1 D.n+5
|
|
| 23. | 详细信息 |
|
A、B两种元素为某周期第ⅡA族和第ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能正确的有几种 ①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32 A.二种 B.三种 C.四种 D.五种
|
|
| 24. | 详细信息 |
|
两种微粒含有相同的质子数和电子数,这两种微粒可能是 ①互为同位素的两种不同的原子 ②两种不同元素的原子 ③一种原子和一种分子 ④一种原子和一种离子 ⑤两种不同分子 ⑥一种分子和一种离子 ⑦两种不同阳离子 ⑧两种不同阴离子 ⑨一种阴离子和一种阳离子 A.①③⑤⑦⑧ B.①③⑤⑥⑦⑧ C.①③④⑤⑦ D.全部都是
|
|
| 25. | 详细信息 |
|
核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法中不正确的是 A.最高正价为+3价 B.其最低负价可能为-1价 C.氢化物易溶于水 D.是活泼的非金属元素
|
|
| 26. | 详细信息 | ||||||
|
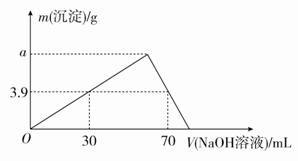
.A、B、C三种元素的原子具有相同的电子层数;B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多5;1 mol A的单质跟盐酸反应可置换出11.2 L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答: (1)A是________元素,B是________元素,C的离子结构示意图________。 (2)分别写出A、B最高价氧化物对应水化物分别与C的气态氢化物水溶液反应的离子方程式:______________________________、__________________________。 (3)已知金属元素D和元素A、B在同一周期。分别向B、D最高价氧化物对应水化物中滴入A的最高价氧化物对应水化物的溶液,观察到的现象为________________________ 发生反应的化学方程式为_____________________________________________________。 (4)A、B、C三种离子的半径由大到小的顺序为__________________(离子符号表示)。 (5)向一定体积的DC3溶液中滴入a mol·L-1的NaOH溶液,产生沉淀的质量与NaOH溶液体积的关系如图所示,则a=________ 。 7.8
|
|||||||
| 27. | 详细信息 |
|
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体。据此回答下列问题: (1)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_____________________________________________________(分解反应)。 (2)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:___________________________________。
(3)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A为强碱,B遇盐酸产生黄绿色气体,则A的化学式为__________,B的电子式为___________________________。 B与盐酸反应的离子方程式为________________________________________________
|
|
| 28. | 详细信息 |
|
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。 实验操作步骤: Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。 Ⅱ.A中看到白色沉淀时,…,关闭活塞a。 请回答: (1)B中反应的离子方程式是 _________________________________________。 (2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。 A.挥发性 B.还原性 C.氧化性 D.酸性 (3)C装置的作用是______________,X是____________________(写化学式)。 (4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是_______________,D中反应的化学方程式是__________________________________。 (5)碳、硅的非金属性逐渐减弱的原因是______________(从原子结构角度加以解释)。
|
|

 元素
元素