2018贵州高一上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( ) A. 野火烧不尽,春风吹又生 B. 春蚕到死丝方尽,蜡炬成灰泪始干 C. 粉身碎骨浑不怕,要留清白在人间 D. 爆竹声中一岁除,春风送暖入屠苏
|
|
| 2. | 详细信息 |
|
下列叙述正确的是( ) A. 1 mol H2O的质量为18g/mol B. CH4的摩尔质量为16g C. 3.01×1023个SO2分子的质量为32g D. 标准状况下,1 mol任何物质体积均为22.4L
|
|
| 3. | 详细信息 |
|
现有三组实验:①除去混在植物油中的水②回收碘的CCl4溶液中的CCl4③用食用酒精浸泡中草药提取其中的有效成分。分离以上混合液的正确方法依次是( ) A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液 C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
|
|
| 4. | 详细信息 |
|
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( ) A. K+、MnO4-、Cl-、SO42- B. Na+、CO32-、SO42-、Cl- C. NO3-、Na+、HCO3-、Mg2+ D. Na+、NO3-、H+、SO42-
|
|
| 5. | 详细信息 |
|
下列现象与胶体的性质无关的是( ) A. 将盐卤或石膏加入豆浆中,制成豆腐 B. 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 D. 清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽景象
|
|
| 6. | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列说法正确的是( ) A. 常温常压下,2.24 L H2O中分子的数目为0.1 NA B. 0.1 mol·L-1 NH4Cl溶液中含有Cl-的数目为0.1 NA C. 常温下,1.7 g NH3中含有氢原子数目为0.3 NA D. 5.6 g铁粉在足量稀盐酸反应,转移的电子数目为0.3NA
|
|
| 7. | 详细信息 |
|
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤。正确的操作顺序是 ( ) A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
|
|
| 8. | 详细信息 |
|
下列反应的离子方程式书写正确的是( ) A. 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓ B. 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ C. 硫酸铜溶液中加入铁粉反应:Cu2++Fe=Fe2++Cu D. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
|
|
| 9. | 详细信息 |
|
在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是 ( ) A. 气体A与气体B的相对分子质量比为m:n B. 同质量的气体A与B的分子个数比为n:m C. 同温同压下,A气体与B气体的密度比为n:m D. 同温同压下,同体积的A气体与B气体的质量比为m:n
|
|
| 10. | 详细信息 |
|
已知下列反应:Co2O3+ 6HCl(浓) = 2CoCl2+ Cl2↑+ 3H2O (I) 5Cl2+ I2+ 6H2O = 10HCl + 2HIO3(II) 下列说法正确的是( ) A. 反应I中HCl是氧化剂 B. 反应II 中Cl2发生氧化反应 C. 还原性:CoCl2> HCl > I2 D. 氧化性:Co2O3> Cl2>HIO3
|
|
| 11. | 详细信息 |
|
在酸性条件下,可发生如下反应: A. +4 B. +5 C. +6 D. +7
|
|
| 12. | 详细信息 |
|
下列变化中,必须加入还原剂才可以实现的是( ) A. Cl2→KClO3 B. Fe2(SO4)3→FeSO4 C. CO→CO2 D. Cu→CuO
|
|
| 13. | 详细信息 |
|
对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是 A. Cl2是氧化剂,NaOH是还原剂 B. 每生成1mol的NaClO3转移6mol的电子 C. Cl2既是氧化剂又是还原剂 D. 被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
|
|
| 14. | 详细信息 |
|
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( ) A.
|
|
| 15. | 详细信息 |
|
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:( ) (1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀: (2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。 下列说法正确的是 A. (2)中产生的气体可能CO2或SO2 B. 溶液X中一定存在SO42-、HCO3-、Mg2+ C. 溶液X中一定不存在Fe3+,可能存在Cl- D. (1)中产生的白色沉淀一定含有BaSO4,可能含有BaSO3
|
|
| 16. | 详细信息 |
|
下列实验操作中错误的是( ) A. 蒸发操作时,不能使混合物中的水分完全蒸干后,才停止加热 B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
|
|
| 17. | 详细信息 |
|
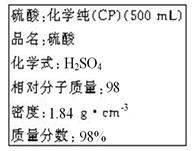
实验题:如图是某硫酸试剂瓶标签上的内容。
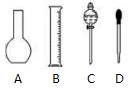
(1)该硫酸的物质的量浓度是____________mol/L。 (2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。 (3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。
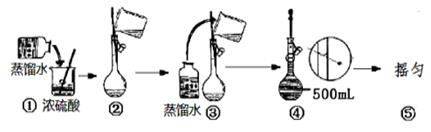
(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。
(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏低的是_____。 A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未经干燥处理 C.定容时仰视观察液面 D.摇匀后发现液面低于刻度线继续加水定容
|
|
| 18. | 详细信息 | ||||||||||||
|
在下列物质:①烧碱 ②盐酸 ③干冰 ④固体BaSO4 ⑤纯碱(Na2CO3)⑥铁 ⑦熔化的KNO3 ⑧酒精(C2H5OH) (1)属于电解质的是___________(填序号,下同),属于非电解质的是________。能导电的是_______。 (2)纯碱的电离方程式是____________________________。 (3)a、b、c、d是Na2CO3、BaCl2、HCl、AgNO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
① 写出c+d反应的离子方程式__________________。
|
|||||||||||||
| 19. | 详细信息 |
|
在下列反应中: A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑ C.3NO2+H2O=2HNO3+NO D.2H2O 其中水只作氧化剂的是________________,水只作还原剂的是________________,水既作氧化剂又作还原剂的是______________,水既不作氧化剂又不作还原剂的是_______________。
|
|
| 20. | 详细信息 |
|
回答下列问题: (1)标准状况下11.2L NH3中含_________个氨分子,_____________mol氢原子。 (2)等质量的SO2和SO3物质的量之比是_____________;所含的氧原子个数之比是________。 (3)含0.4mol A13+的Al2(SO4)3中所含的SO42﹣的物质的量是__________。 (4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是__________。
|
|
| 21. | 详细信息 |
|
一个体重50kg的健康人含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁. (1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____________. A.Fe B.Fe2+ C.Fe3+ (2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有_________性.下列也能实现这种转化的物质是____________(填字母序号). A.Cl2 B. H2 C.FeCl2 D.浓硫酸 (3)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O的反应中,HNO3表现了____________性和____________性,每有1mol Cu参加反应,转移电子____________mol.
|
|
| 22. | 详细信息 |
|
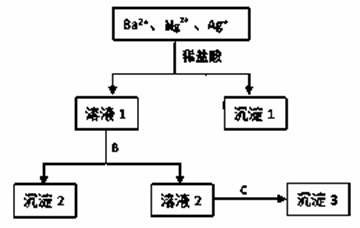
某溶液中只含有Ba2+ 、Mg2+ 、Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
(1)沉淀1的化学式为__________,生成该沉淀的离子方程式为_______________。 (2)若试剂B为Na2SO4溶液,则沉淀2化学式为_______________。取溶液2反应前,怎样检验SO42-已除去_______________。 (3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为_______________。 (4)如果原溶液中Ba2+ 、Mg2+ 、Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为________mol·L-1。
|
|