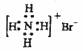2017北京高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列有关化学用语使用正确的是 A. NH4Br的电子式: B. S的原子结构示意图: C. 乙酸的分子式:CH3COOH D. 原子核内有18个中子的氯原子:
|
|
| 2. | 详细信息 |
|
下列各组中互为同位素的是 A.
|
|
| 3. | 详细信息 | ||||||||
|
古丝绸之路贸易中的下列商品,主要成分属于无机物的是
|
|||||||||
| 4. | 详细信息 |
|
下列化学反应在金属冶炼工业中还没有得到应用的是 A. 2NaCl(熔融) C. Fe2O3+3CO
|
|
| 5. | 详细信息 |
|
下列关于原子结构、元素性质的说法正确的是 A. 非金属元素组成的化合物中只含共价键 B. IA族金属元素是同周期中金属性最强的元素 C. 同种元素的原子均有相同的质子数和中子数 D. ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
|
|
| 6. | 详细信息 |
|
2016年IUPAC命名117号元素为Ts(中文名“ A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数 C. Ts在同族元素中非金属性最弱 D. 中子数为176的Ts核素符号是
|
|
| 7. | 详细信息 |
|
下列每组中各物质内既有离子键又有共价键的一组是 A. NaOH、H2SO4、(NH4)2SO4 B. MgO、Na2SO4、NH4HCO3 C. Na2O2、KOH、Na2SO4 D. HCl、Al2O3、MgCl2
|
|
| 8. | 详细信息 |
|
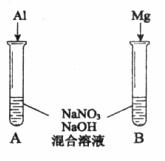
铝热反应不仅被应用于焊接钢轨,而且常应用于冶炼熔点较高的金属如钒、铬、锰等。这是利用了铝的①还原性 ②导电性 ③与强酸和强碱均反应 ④被氧化的过程放出大量的热 A. ① B. ①④ C. ①③④ D. ①②③④
|
|
| 9. | 详细信息 |
|
反应A(g)+3B(g)=2C(g)+2D(g)在不同情况下测得化学反应速率,其中最快的是 A. C.
|
|
| 10. | 详细信息 |
|
糖类、油脂和蛋白质是生命活动所必需的营养物质。下列叙述正确的是 A. 植物油不能发生水解反应 B. 葡萄糖能发生氧化反应和水解反应 C. 淀粉水解的最终产物是葡萄糖 D. 蛋白质遇浓硫酸变为黄色
|
|
| 11. | 详细信息 |
|
下列叙述不正确的是 A. 可以用NaOH溶液鉴别MgCl2和AlCl3 B. 可以用溴水鉴别甲烷和乙烯 C. 可以用分液漏斗分离乙酸和乙醇 D. 可以用NaOH溶液除去苯中少量的Br2
|
|
| 12. | 详细信息 |
|
下列说法正确的是 A. 石油裂解得到的汽油是纯净物 B. 石油产品都可用于聚合反应 C. 天然气是一种清洁的化石燃料 D. 水煤气是通过煤的液化得到的气体燃料
|
|
| 13. | 详细信息 |
|
砷(As)为第4周期ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是 A. 砷可以有-3、+3、+5等多种化合价 B. 砷原子的第3电子层含有18个电子 C. H3AsO4的酸性比H3PO4弱 D. 砷的氢化物的稳定性比磷化氢的强
|
|
| 14. | 详细信息 |
|
等质量的下列烃,分别完全燃烧时,消耗O2质量最少的是 A. C6H6 B. CH4 C. C2H4 D. C7H8
|
|
| 15. | 详细信息 |
|
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是 A. X的原子半径一定大于Y的原子半径 B. X与Y的简单离子不可能具有相同的电子层结构 C. 两元素形成的化合物中,原子个数比不可能为1:1 D. X2Y可能是离子化合物,也可能是共价化合物
|
|
| 16. | 详细信息 |
|
. 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是 A. 原子半径的大小顺序:Y<Z<W<X B. 化合物YX、ZX2、WX3中化学键的类型相同 C. 非金属性的强弱顺序:X>W>Z D. 元素W的最高价氧化物对应水化物的酸性比Z的弱
|
|
| 17. | 详细信息 |
|
下列说法错误的是 A. 化学反应中能量变化的大小与反应物的质量多少无关 B. 化学变化中的能量变化主要是由于化学键变化引起的 C. 能量变化是化学反应的基本特征之一 D. 各种物质都储存有化学能,物质的组成、结构不同,所包含的化学能也不同
|
|
| 18. | 详细信息 |
|
一定温度下的恒容密闭容器中,反应A2(g)+B2(g) A. 容器内 B. 单位时间内生成2n molAB,同时生成n mol A2 C. 生成B的速率与生成A的速率相等 D. 容器内气体的密度不随时间变化
|
|
| 19. | 详细信息 |
|
使用氢氧燃料电池的汽车已在北京街头出现。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下: 2H2+4OH——4e-=4H2O O2+2H2O+4e-=4OH- 下列有关该氢氧燃料电池的说法中,正确的是 A. H2在正极发生氧化反应 B. 供电时的总反应是2H2+O2 C. 氢氧燃料电池中反应放出的热量转变为电能 D. 电解质溶液中OH-向负极移动
|
|
| 20. | 详细信息 |
|
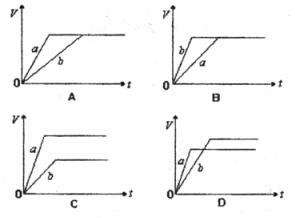
等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是
|
|
| 21. | 详细信息 |
|
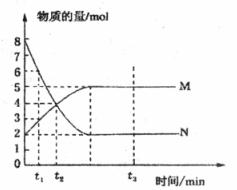
在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是
A. 0~t2内用M表示的平均反应速率是2/t2(mol· B. t1~t2内容器内的压强逐渐减小 C. 该反应的方程式为N D. t2与t3时刻的混合气体的平均相对分子质量相等
|
|
| 22. | 详细信息 | |||||||||||||||
|
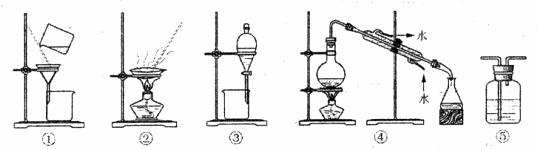
下列实验操作不能实现实验目的的是
|
||||||||||||||||
| 23. | 详细信息 |
|
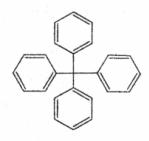
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是
A. 分子式为C25H20 B. 分子中所有原子有可能处于同一平面 C. 该化合物分子中所有原子不可能处于同一平面 D. 该分子能发生取代反应
|
|
| 24. | 详细信息 |
|
某厂用Na除掉苯中的水分。某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na。下列处理方法更合理、更安全的是 A. 打开反应釜,将Na暴露在空气中与氧气反应 B. 向反应釜通入Cl2,Na在Cl2中燃烧生成NaCl C. 向反应釜加大量H2O,通过化学反应“除掉”金属钠 D. 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量
|
|
| 25. | 详细信息 |
|
下列实验中,所选装置不合理的是
A. 分离Na2CO3溶液和CH3COOC2H5,选④ B. 粗盐提纯,选①和② C. 用CCl4提取碘水中的碘,选③ D. 用FeCl2溶液吸收Cl2,选⑤
|
|
| 26. | 详细信息 |
|
化学与社会、生产、生活密切相关,下列说法正确的是 A. 柠檬属于酸性食物 B. 油脂是人类维持生命活动所需能量的主要来源 C. PM2.5是指空气中氮氧化物和硫氧化物含量之和 D. 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性
|
|
| 27. | 详细信息 |
|
K35ClO3晶体与H37Cl浓溶液发生反应生成氯气、氯化钾和水。则此反应生成的氯气的相对分子质量为 A. 70.6 B. 73 C. 73.3 D. 74
|
|
| 28. | 详细信息 |
|
对可逆反应4NH3(g)+5O2 A. 达到化学平衡时,4 B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 D. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
|
|
| 29. | 详细信息 |
|
下列解释事实的化学方程式或离子方程式正确的是 A. 在燃煤时加入适量石灰石,可减少SO2的排放:CaCO3+SO2=CaSO3+CO2 B. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH一+H++SO42=BaSO4↓+H2O D. 向海带灰浸出液中加入硫酸、双氧水:
|
|
| 30. | 详细信息 |
|
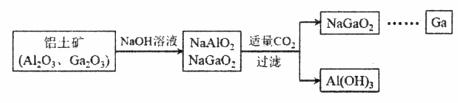
镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:
下列判断不合理的是 A. Al、Ga均处于ⅢA族 B. Ga2O3可与盐酸反应生成GaCl3 C. Ga(OH)3可与NaOH反应生成NaGaO2 D. 酸性:Al(OH)3>Ga(OH)3
|
|
| 31. | 详细信息 |
|
A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答: (1)B元素在周期表中的位置为_____________________; (2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为_____________________。 (3)A、C两元素可组成10电子粒子X-。Y与X-具有相同的原子种类及数目,且不带电,Y的电子式为_________________。 (4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为___________________。 (5)我国首创的海洋电池以E的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为_______________,电池总反应的化学方程式为____________________。
|
|
| 32. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||
|
下表是稀硫酸与某金属反应的实验数据:(化学反应速率与能量)
分析上述数据,请回答下列问题。 (1)实验1和3表明,_____________对该反应速率有影响,能表明这种影响因素的实验还有_____________(填实验序号)。 (2)本实验中影响反应速率的其他因素还有___________,其实验序号是___________。该实验说明______________,则该反应速率越快。 (3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: _______________________。
|
|||||||||||||||||||||||||||||||||||||||||||
| 33. | 详细信息 |
|
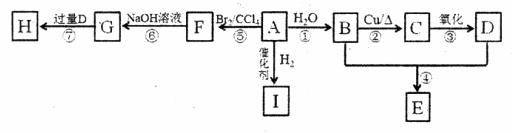
A~I是常见有机物,它们之间的转化关系如下图所示。其中A是一种烃,E的分子式为C4H8O2,H为有香味的油状物质。
已知:CH3CH2Br+NaOH (1)0.2mol A完全燃烧生成17.6 g CO2,7.2g H2O,则A的结构简式为____________。 (2)D、G分子中含有官能团的名称分别为______________、________________。 (3)①、②、⑥的反应类型分别为_____________、______________、______________。 (4)有机物G可能具有的性质为_______________。 a. 与金属钠反应 b. 与NaOH溶液反应 c. 易溶于水 (5)请写出②和⑦的化学方程式 反应②__________________; 反应⑦__________________。 (6)J是有机物I的同系物,且比I多3个碳原子,请写出J可能的结构简式____________。
|
|
| 34. | 详细信息 |
|
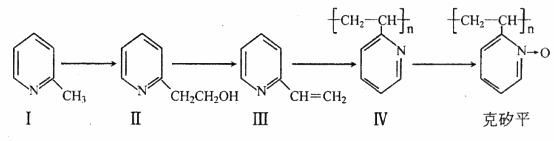
克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以在一定条件下与氢气发生反应生成下图所示结构,其反应方程式为__________;反应类型为_________。
(2)化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为_______________; (3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是________(填字母): A. 化合物Ⅱ可以与CH3COOH发生酯化反应 B. 化合物Ⅱ不能发生催化氧化反应 C. 化合物Ⅲ可以使溴的四氯化碳溶液褪色 D. 化合物Ⅲ不能使酸性高锰酸钾溶液褪色 (4)化合物Ⅲ生成化合物Ⅳ的反应方程式为_________;反应类型为____________。
|
|
| 35. | 详细信息 |
|
聚乳酸是一种新型可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料。聚乳酸材料废弃后,先水解成乳酸( (1)乳酸的工业生产可以采用生物发酵法。
①检验淀粉是否完全水解,可以选用的一种试剂是___________(填序号)。 a. 溴水 b. 银氨溶液 c. 碘酒 d. 碘化钾溶液 ②淀粉水解的化学方程式是_______________。 (2)乳酸的生产也可以采用有机合成法,其中的一种方法是丙酸法。
①反应Ⅰ的反应类型是___________反应。 ②进行反应Ⅱ时,需要加入过量的乙醇,这样做的目的是_______________。 (3)两个乳酸分子之间可以形成环状的酯,该环状酯的结构简式是______________; (4)乳酸的某同分异构体有下列性质: i. 能发生银镜反应: ii. 1 mol该物质与足量金属钠反应可生成2 g氢气; iii. 该物质分子中有一个碳原子与4种不同的原子或原子团相连。 写出该同分异构体发生银镜反应的化学方程式__________________。
|
|
| 36. | 详细信息 |
|
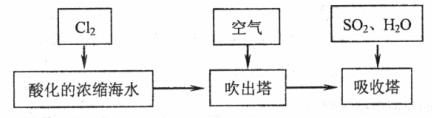
溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
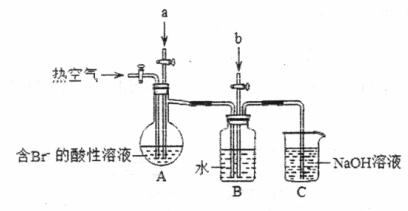
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)
(1)A装置中通入a气体的目的是(用离子方程式表示)_____________; (2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是____________; (3)B装置中通入的b气体是___________,目的是使溴蒸气转化为氢溴酸以达到富集的目的,试写出该反应的化学方程式______________; (4)C装置的作用是____________。
|
|
| 37. | 详细信息 |
|
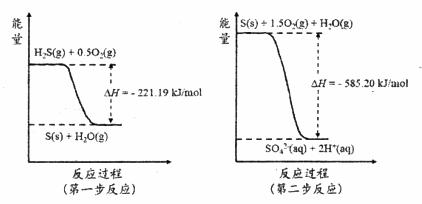
研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。 (1)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
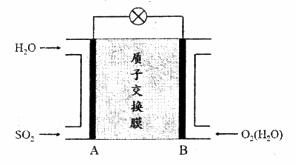
1mol HS(g)全部氧化成SO42-(aq)_________(填“吸收”或“放出”)热量________KJ/mol。 (2)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
①质子的流动方向为__________(填“从A到B”或“从B到A”)。 ②负极的电极反应式为_________________。 (3)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
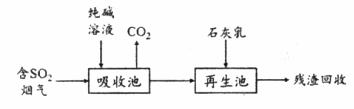
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是_______________。 ②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是_______________。
|
|
| 38. | 详细信息 | |||||||||||
|
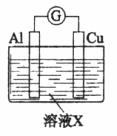
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
(1)实验Ⅰ中,铝片作_________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是___________。 (2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是_______________。 查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。 (3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。 ①反应后的溶液中含NH4+。实验室检验NH4+的方法是____________。 ②生成NH4+的电极反应式是____________。 (4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:
①观察到A中有NH3生成,B中无明显现象。 A、B产生不同现象的解释是___________。 ②A中生成NH3的离子方程式是______________。
|
||||||||||||