2016еӣӣе·қй«ҳдёүдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰејҖеӯҰиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮиҒ”зі»гҖӮдёӢеҲ—жңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A.зҪ‘зҠ¶з»“жһ„зҡ„иҒҡдёҷзғҜй…ёй’ жҳҜй«ҳеҗёж°ҙжҖ§ж ‘и„ӮпјҢеҸҜз”ЁдәҺеҲ¶йҖ вҖңе°ҝдёҚж№ҝвҖқ B.е…үеҜјзәӨз»ҙеә”йҒҝе…ҚеңЁејәзўұжҖ§зҺҜеўғдёӯдҪҝз”Ё C.еҲ©з”Ёи¶…дёҙз•ҢCO2жөҒдҪ“дҪңдёәиҗғеҸ–жә¶еүӮз¬ҰеҗҲз»ҝиүІеҢ–еӯҰ D.иҲ№дҪ“й•Җй”ҢжҲ–й”ЎеқҮеҸҜдҝқжҠӨиҲ№дҪ“пјҢй•ҖеұӮз ҙжҚҹеҗҺе°Ҷз«ӢеҚіеӨұеҺ»дҝқжҠӨдҪңз”Ё |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A.l mol H2OжңҖеӨҡеҸҜеҪўжҲҗж°ўй”®ж•°зӣ®дёә2NA B.ж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2 Lз”ІйҶӣжүҖеҗ«зҡ„Пғй”®ж•°зӣ®дёә2NA C.еёёжё©дёӢпјҢ46 g NO2жүҖеҗ«еҲҶеӯҗж•°зӣ®дёәNA D.pH=lзҡ„зЎ«й…ёдёӯжүҖеҗ« |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ A.й…ҚеҲ¶й“¶ж°Ёжә¶ж¶Іж—¶зҡ„жҖ»еҸҚеә”пјҡAg++3NH3В·H2O B.еҗ‘1 mL 0.l mol/LзЎқй…ёдәҡй“Ғжә¶ж¶ІеҠ е…Ҙ1 mL 0.1 mol/Lзҡ„HIжә¶ж¶Іпјҡ3 Fe2++ C.еҗ‘10 mL 0.l mol/L NH4Al(SO4)2жә¶ж¶ІдёӯеҠ е…Ҙ0.1 mol/L Ba(OH)2жә¶ж¶ІиҮіжҒ°еҘҪеҸӘжңүдёҖз§ҚжІүж·Җж—¶пјҡ D.еҗ‘й«ҳй”°й…ёй’ҫй…ёжҖ§жә¶ж¶Ідёӯж»ҙеҠ H2O2жә¶ж¶ІпјҢй«ҳй”°й…ёй’ҫжә¶ж¶Ізҙ«зәўиүІиӨӘеҺ»пјҡ2+7H2O2+6H+ |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
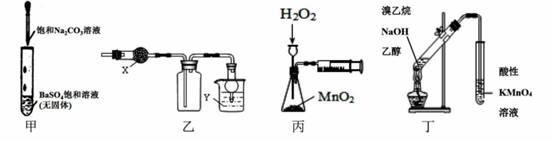
еҲ©з”ЁдёӢеҲ—е®һйӘҢиЈ…зҪ®иғҪиҫҫеҲ°зӣёеә”е®һйӘҢзӣ®зҡ„зҡ„жҳҜ
A.з”ІеҸҜз”ЁдәҺз ”з©¶жІүж·Җзҡ„иҪ¬еҢ–пјҢеҸҜжҜ”иҫғеҮәKsp(BaSO4)>Ksp (BaCO3) B.д№ҷдёӯXдёәж— ж°ҙCaCI2пјҢYдёәNaOHжә¶ж¶Іж—¶пјҢиҜҘиЈ…зҪ®еҸҜз”ЁдәҺSO2зҡ„收йӣҶ C.дёҷиЈ…зҪ®еҸҜе®ҡйҮҸжөӢе®ҡH2O2зҡ„еҲҶи§ЈйҖҹзҺҮ D.дёҒеҸҜз”ЁдәҺиҜҒжҳҺе®һйӘҢдёӯз”ҹжҲҗдәҶд№ҷзғҜ |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫдёәжҹҗй«ҳж•Ҳй”ӮзЎ«з”өжұ гҖӮе…ідәҺиҜҘз”өжұ зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
A.з”өеӯҗжөҒеҗ‘пјҡBз”өжһҒвҶ’з”Ёз”өеҷЁвҶ’Aз”өжһҒвҶ’з”өи§ЈиҙЁвҶ’Bз”өжһҒ B.Aз”өжһҒдёҠеҸ‘з”ҹзҡ„дёҖдёӘз”өжһҒеҸҚеә”дёәпјҡ2Li++S8+2e- C.иӢҘз”ЁиҜҘз”өжұ еңЁй“ҒеҷЁдёҠй•Җй”ҢпјҢз”өи·ҜдёӯиҪ¬з§»2 moIз”өеӯҗж—¶пјҢз”өй•Җжұ дёӨз”өжһҒиҙЁйҮҸе·®дёә65 g D.иӢҘз”ЁиҜҘз”өжұ з”өи§ЈзІҫзӮјй“ңпјҢиҙҹжһҒеҮҸе°‘7 gж—¶йҳіжһҒеҮҸе°‘иҙЁйҮҸдёә32 g |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӨдёӘеӣәе®ҡе®№з§ҜеқҮдёә1LеҜҶй—ӯе®№еҷЁдёӯд»ҘдёҚеҗҢзҡ„ж°ўзўіжҜ”[n(H2)/n(CO2)]е……е…ҘH2е’ҢCO2пјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҡ2CO2(g)+6H2 (g)
A.иҜҘеҸҚеә”еңЁй«ҳжё©дёӢиҮӘеҸ‘иҝӣиЎҢ B.ж°ўзўіжҜ”пјҡX<2.0 C.ж°ўзўіжҜ”дёә2.0ж—¶пјҢQзӮ№v(H2)йҖҶе°ҸдәҺPзӮ№зҡ„v(H2)йҖҶ D.еҗ‘еӨ„дәҺPзӮ№зҠ¶жҖҒзҡ„е®№еҷЁдёӯпјҢжҢү2вҲ¶4вҲ¶1вҲ¶4зҡ„жҜ”дҫӢеҶҚе……е…ҘCO2гҖҒH2гҖҒC2H4гҖҒH2OпјҢеҶҚж¬Ўе№іиЎЎеҗҺa(CO2)еҮҸе°Ҹ В |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ | ||||||
|
е·ұзҹҘпјҡдёӢиЎЁдёә25в„ғж—¶жҹҗдәӣејұй…ёзҡ„з”өзҰ»е№іиЎЎеёёж•°гҖӮ
еҰӮеӣҫиЎЁзӨәеёёжё©дёӢпјҢзЁҖйҮҠCH3COOHгҖҒHClOдёӨз§Қй…ёзҡ„зЁҖжә¶ж¶Іж—¶пјҢжә¶ж¶ІpHйҡҸеҠ ж°ҙйҮҸзҡ„еҸҳеҢ–гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
A.еӣҫдёӯc(H+):c(R-)зҡ„еҖјпјҡaзӮ№>cзӮ№(HRд»ЈиЎЁCH3COOHжҲ–HCIO) B.pHзӣёеҗҢзҡ„еӣӣз§Қжә¶ж¶Іжө“еәҰе…ізі»пјҡc(CH3COONa)>c(NaHCO3)>c(NaClO>c(Na2CO3) C.еӣҫдёӯaзӮ№й…ёзҡ„жҖ»жө“еәҰе°ҸдәҺbзӮ№й…ёзҡ„жҖ»жө“еәҰ D.жө“еәҰеқҮдёә0.l mol/Lзҡ„CH3COONaе’ҢNaCIOзҡ„ж··еҗҲжә¶ж¶Ідёӯпјҡc(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH) |
|||||||
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFжҳҜеүҚеӣӣе‘ЁжңҹеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„е…ӯз§Қе…ғзҙ гҖӮAе…ғзҙ еҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗж•°зӯүдәҺе…¶з”өеӯҗеұӮж•°пјҢBе…ғзҙ еҹәжҖҒеҺҹеӯҗжңүдёүдёӘиғҪзә§дё”еҗ„иғҪзә§з”өеӯҗж•°зӣёеҗҢпјҢAдёҺDеҸҜеҪўжҲҗдёӨз§Қеёёи§Ғж¶ІжҖҒеҢ–еҗҲзү©GгҖҒHпјҢе…¶еҺҹеӯҗж•°д№ӢжҜ”еҲҶеҲ«дёә1вҲ¶1е’Ң2вҲ¶1пјҢEе…ғзҙ еҺҹеӯҗзҡ„KгҖҒLеұӮз”өеӯҗж•°д№Ӣе’ҢзӯүдәҺе…¶MгҖҒNеұӮз”өеӯҗж•°д№Ӣе’ҢпјҢFиў«з§°дёә继й“ҒгҖҒй“қд№ӢеҗҺзҡ„第дёүйҮ‘еұһпјҢеҸҜз”ЁдәҺеҲ¶йҖ йЈһжңәгҖҒзҒ«з®ӯгҖҒдәәйҖ еҚ«жҳҹгҖҒе®Үе®ҷйЈһиҲ№зӯүйўҶеҹҹгҖӮиҜ·еӣһзӯ”дёӢеҲ—еҗ„йўҳ(ж¶үеҸҠе…ғзҙ иҜ·з”Ёзӣёеә”еҢ–еӯҰз¬ҰеҸ·иЎЁзӨә)пјҡ (1)BгҖҒCгҖҒDдёӯ第дёҖз”өзҰ»жңҖеӨ§зҡ„е…ғзҙ е…¶еҹәжҖҒеҺҹеӯҗжңү__з§ҚдёҚеҗҢиғҪйҮҸзҡ„з”өеӯҗгҖӮ (2)GеҲҶеӯҗдёӯDеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёә____пјҢF2+зҡ„еҹәжҖҒд»·з”өеӯҗжҺ’еёғејҸдёә____гҖӮ (3) (4)жҹҗеҢ–еҗҲзү©жҷ¶иғһз»“жһ„еҰӮеӣҫжүҖзӨәпјҢВ E2+зҡ„й…ҚдҪҚж•°жҳҜВ В В гҖӮ
(5)з”Ёй«ҳиғҪе°„зәҝз…§е°„ж¶ІжҖҒHж—¶пјҢдёҖдёӘHеҲҶеӯҗиғҪйҮҠж”ҫеҮәдёҖдёӘз”өеӯҗпјҢеҗҢж—¶дә§з”ҹдёҖз§ҚйҳізҰ»еӯҗгҖӮ в‘ йҮҠж”ҫеҮәжқҘзҡ„з”өеӯҗеҸҜд»Ҙиў«иӢҘе№ІHеҲҶеӯҗеҪўжҲҗзҡ„вҖңзҪ‘вҖқжҚ•иҺ·пјҢдҪ и®ӨдёәHеҲҶеӯҗй—ҙиғҪеҪўжҲҗвҖңзҪ‘вҖқзҡ„еҺҹеӣ жҳҜВ В В гҖӮ в‘Ўз”ұHеҲҶеӯҗйҮҠж”ҫеҮәз”өеӯҗж—¶дә§з”ҹзҡ„дёҖз§ҚйҳізҰ»еӯҗе…·жңүиҫғејәзҡ„ж°§еҢ–жҖ§пјҢиҜ•еҶҷеҮәиҜҘйҳізҰ»еӯҗдёҺSO2зҡ„ж°ҙжә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣиҜҘйҳізҰ»еӯҗиҝҳиғҪдёҺHеҲҶеӯҗдҪңз”Ёз”ҹжҲҗзҫҹеҹәпјҢз»ҸжөӢе®ҡжӯӨж—¶зҡ„Hе…·жңүй…ёжҖ§пјҢеҶҷеҮәиҜҘиҝҮзЁӢзҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
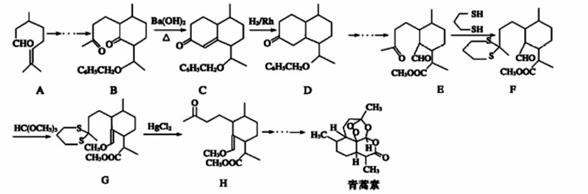
2015е№ҙжҲ‘еӣҪиҚҜзү©еҢ–еӯҰ家еұ е‘Ұе‘Ұеӣ жҠ—з–ҹз–ҫж–°иҚҜйқ’и’ҝзҙ е’ҢеҸҢж°ўйқ’и’ҝзҙ иў«жҺҲдәҲиҜәиҙқе°”з”ҹзҗҶеӯҰжҲ–еҢ»еӯҰеҘ–гҖӮйқ’и’ҝзҙ зҡ„дёҖз§ҚеҢ–еӯҰеҗҲжҲҗж–№жі•йғЁеҲҶе·ҘиүәжөҒзЁӢеҰӮеӣҫпјҡ
е·ұзҹҘпјҡ
(1)еҢ–еҗҲзү©Hдёӯзҡ„еҗ«ж°§е®ҳиғҪеӣўзҡ„еҗҚз§°дёәВ В В гҖӮ (2)иҜҘж–№жі•и®ҫи®ЎEвҶ’FвҶ’GвҶ’Hзҡ„зӣ®зҡ„жҳҜВ В В гҖӮ (3) BвҶ’Cзҡ„еҸҚеә”е®һйҷ…еҸҜзңӢдҪңеҲҶдёӨжӯҘиҝӣиЎҢпјҢеҲҷж¶үеҸҠзҡ„еҸҚеә”зұ»еһӢдҫқж¬Ўдёә________гҖӮ (4)жЈҖйӘҢAдёӯйҶӣеҹәзҡ„ж–№жі•жҳҜВ В В (иҜ·з”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁиҫҫ)гҖӮ (5)AеңЁжқЎд»¶дёӢеҸҚеә”еҗҺзҡ„дә§зү©зҡ„еҗҚз§°дёә В В В В В В В В В В В В В В В В В В В В В пјӣиҜҘдә§зү©зҡ„дёҖз§ҚеҗҢеҲҶејӮжһ„дҪ“Xж»Ўи¶ідёӢеҲ—иҰҒжұӮпјҡв‘ еҲҶеӯҗдёӯеҗ«е…ӯе…ғзҺҜпјӣв‘ЎдёҚиғҪдёҺйҮ‘еұһй’ еҸҚеә”пјӣв‘ўж ёзЈҒе…ұжҢҜж°ўи°ұжҳҫзӨәжңүеӣӣз»„еі°пјҢеҲҷXзҡ„з»“жһ„з®ҖејҸдёәВ В В (д»»еҶҷдёҖз§Қ)гҖӮ (6)з”ұе·ІзҹҘHдёҺзЁҖзЎ«й…ёе…ұзғӯж—¶еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә____гҖӮ |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еҶ¬ж—ҘпјҢйӣӘиҠұжј«иҲһпјҢз»ҷдәәеёҰжқҘзҫҺзҡ„дә«еҸ—пјҢдҪҶйҷҚйӣӘеҚҙдјҡеҜјиҮҙйҒ“и·ҜйҖҡиЎҢй—®йўҳгҖӮзҺ°жңүдёҖз§Қй«ҳйҖҹе…¬и·Ҝзҡ„з»ҝиүІиһҚйӣӘеүӮ-CMA(йҶӢй…ёй’ҷгҖҒйҶӢй…ёй•ҒеӣәдҪ“зҡ„ж··еҗҲзү©)пјҢе…¶з”ҹдә§еёёд»ҘзҷҪдә‘зҹі(дё»иҰҒжҲҗеҲҶMgCO3В·CaCO3пјҢеҗ«SiO2зӯүжқӮиҙЁ)е’Ңз”ҹзү©иҙЁеәҹж¶ІвҖ”вҖ”жңЁйҶӢж¶І(дё»иҰҒжҲҗеҲҶд№ҷй…ёпјҢд»ҘеҸҠе°‘йҮҸзҡ„з”ІйҶҮгҖҒиӢҜй…ҡгҖҒз„ҰжІ№зӯүжқӮиҙЁ)зӯүдёәеҺҹж–ҷпјҢжөҒзЁӢеҰӮдёӢпјҡ
(1)жӯҘйӘӨв‘ еҸ‘з”ҹзҡ„еҸҚеә”зҰ»еӯҗж–№зЁӢејҸдёәВ В В гҖӮ (2)ж»ӨжёЈ1зҡ„дё»иҰҒжҲҗеҲҶдёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В (е·ұзҹҘl mol NaOHеҸ‘з”ҹеҸҚеә”ж—¶ж”ҫеҮәзғӯйҮҸдёәQkJ)пјӣжӯҘйӘӨв‘ЎжүҖеҫ—ж»Өж¶Іеёёе‘ҲиӨҗиүІпјҢеҲҶжһҗеҸҜзҹҘе…¶еҺҹеӣ дё»иҰҒжҳҜжңЁйҶӢж¶Ідёӯеҗ«жңүе°‘йҮҸзҡ„жңүиүІзҡ„з„ҰжІ№д»ҘеҸҠ____гҖӮ (3)е·ІзҹҘCMAдёӯй’ҷгҖҒй•Ғзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёҺеҮәж°ҙзҺҮ(дёҺиһҚйӣӘж•ҲжһңжҲҗжӯЈжҜ”)е…ізі»еҰӮеӣҫжүҖзӨәпјҢжӯҘйӘӨв‘Јзҡ„зӣ®зҡ„йҷӨи°ғиҠӮn(Ca):n(Mg) зәҰдёә____(йҖүеЎ«пјҡ1:3пјӣ1:2пјӣ 3:7пјӣ 2:3)еӨ–пјҢеҸҰдёҖзӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В гҖӮ
(4)жӯҘйӘӨв‘ҘеҢ…еҗ«зҡ„ж“ҚдҪңжңүВ В В гҖҒиҝҮж»ӨгҖҒжҙ—ж¶ӨеҸҠе№ІзҮҘгҖӮ (5)еҸ–akgеҗ«MgCO3В·CaCO3иҙЁйҮҸеҲҶж•°дёәb%зҡ„зҷҪдә‘зҹіпјҢз»ҸиҝҮдёҠиҝ°жөҒзЁӢеҲ¶еӨҮCMAгҖӮе·ІзҹҘMgCO3В·CaCO3зҡ„жҚҹеӨұзҺҮдёәc%пјҢжӯҘйӘӨв‘Јд№ӢеҗҺеҲ°дә§е“ҒCMAзҡ„жҚҹеӨұзҺҮдёәd%пјҢеҲҷз»“еҗҲ(3)еҸҜзҹҘжүҖеҫ—дә§е“ҒиҙЁйҮҸзәҰдёәВ В В В В В В В В В В В kg(иҜ·з”Ёеҗ«зӣёе…іеӯ—жҜҚзҡ„и®Ўз®—ејҸиЎЁиҫҫпјҢдёҚеҝ…еҢ–з®Җ)гҖӮ |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
йЈҹе“ҒеҠ е·Ҙдёӯеёёз”Ёз„ҰдәҡзЎ«й…ёй’ (Na2S2O5)дҪңжјӮзҷҪеүӮгҖҒйҳІи…җеүӮе’Ңз–ҸжқҫеүӮгҖӮ зҺ°еңЁе®һйӘҢе®ӨеҲ¶еӨҮз„ҰдәҡзЎ«й…ёй’ пјҢе…¶еҸҚеә”дҫқж¬Ўдёәпјҡ (в…°)2NaOH+SO2 (ii)Na2SO3+ H2O+SO2 (iii)2NaHSO3 жҹҘйҳ…иө„ж–ҷпјҡз„ҰдәҡзЎ«й…ёй’ дёәй»„иүІз»“жҷ¶зІүжң«пјҢ150в„ғж—¶ејҖе§ӢеҲҶи§ЈпјҢеңЁж°ҙжә¶ж¶ІжҲ–еҗ«жңүз»“жҷ¶ж°ҙж—¶жӣҙжҳ“иў«з©әж°”ж°§еҢ–гҖӮе®һйӘҢиЈ…зҪ®еҰӮдёӢпјҡ
(l)е®һйӘҢе®ӨеҸҜз”Ёеәҹй“қдёқдёҺNaOHжә¶ж¶ІеҲ¶еҸ–H2пјҢе…¶зҰ»еӯҗж–№зЁӢејҸдёә____гҖӮ (2)йҖҡж°ўж°”дёҖж®өж—¶й—ҙеҗҺпјҢд»ҘжҒ’е®ҡйҖҹзҺҮйҖҡе…ҘSO2пјҢејҖе§Ӣзҡ„дёҖж®өж—¶й—ҙжә¶ж¶Іжё©еәҰиҝ…йҖҹеҚҮй«ҳпјҢйҡҸеҗҺжё©еәҰзј“ж…ўеҸҳеҢ–пјҢжә¶ж¶ІејҖе§ӢйҖҗжёҗеҸҳй»„гҖӮвҖңжё©еәҰиҝ…йҖҹеҚҮй«ҳвҖқзҡ„еҺҹеӣ дёә________гҖӮе®һйӘҢеҗҺжңҹйЎ»еҲ©з”Ёж°ҙжөҙдҪҝжё©еәҰдҝқжҢҒеңЁзәҰ80в„ғгҖӮ (3)еҸҚеә”еҗҺзҡ„дҪ“зі»дёӯжңүе°‘йҮҸзҷҪиүІдәҡзЎ«й…ёй’ жһҗеҮәпјҢйҷӨеҺ»е…¶дёӯдәҡзЎ«й…ёй’ еӣәдҪ“зҡ„ж–№жі•жҳҜ____пјӣ然еҗҺиҺ·еҫ—иҫғзәҜзҡ„ж— ж°ҙNa2S2O5еә”е°Ҷжә¶ж¶ІеҶ·еҚҙеҲ°30в„ғе·ҰеҸіиҝҮж»ӨпјҢжҺ§еҲ¶вҖң30в„ғе·ҰеҸівҖқзҡ„зҗҶз”ұжҳҜ____гҖӮ (4)еӣҫ3дёәзңҹз©әе№ІзҮҘNa2S2O5жҷ¶дҪ“зҡ„иЈ…зҪ®пјҢйҖҡе…ҘH2зҡ„зӣ®зҡ„жҳҜ____гҖӮ (5)еёёз”Ёеү©дҪҷзўҳйҮҸжі•жөӢе®ҡдә§е“Ғдёӯз„ҰдәҡзЎ«й…ёй’ зҡ„иҙЁйҮҸеҲҶж•°гҖӮе·ІзҹҘпјҡ в‘ зІҫзЎ®з§°еҸ–дә§е“Ғ0.2000 gж”ҫе…ҘзўҳйҮҸ瓶(еёҰзЈЁеҸЈеЎһзҡ„й”ҘеҪўз“¶)дёӯгҖӮ в‘ЎеҮҶ确移еҸ–дёҖе®ҡдҪ“з§Ҝзҡ„е·ІзҹҘжө“еәҰзҡ„ж ҮеҮҶзўҳжә¶ж¶І(иҝҮйҮҸ)并记еҪ•ж•°жҚ®пјҢеңЁжҡ—еӨ„ж”ҫзҪ®5 minпјҢ然еҗҺеҠ е…Ҙ5 mLеҶ°йҶӢй…ёеҸҠйҖӮйҮҸзҡ„и’ёйҰҸж°ҙгҖӮ в‘ўз”Ёж ҮеҮҶNa2S2O3жә¶ж¶Іж»ҙе®ҡиҮіжҺҘиҝ‘з»ҲзӮ№гҖӮ в‘Ј____гҖӮ в‘ӨйҮҚеӨҚжӯҘйӘӨв‘ пҪһв‘Јпјӣж №жҚ®зӣёе…іи®°еҪ•ж•°жҚ®и®Ўз®—еҮәе№іеқҮеҖјгҖӮ |
|
- зҰҸе»әзңҒиҺҶ田第дёғдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2019еұҠй«ҳдёүдёҠеҚҠжңҹ第дёүж¬ЎжңҲиҖғзҗҶ科综еҗҲеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲиҘҝи—ҸиҮӘжІ»еҢәжһ—иҠқеёӮ第дёҖдёӯеӯҰпјү
- й»„еҶҲеёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·еҲ·йўҳи®ӯз»ғ
- 2019еұҠй«ҳдёүдёӢеҚҠе№ҙ第дёҖж¬ЎжЁЎжӢҹиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲйҷ•иҘҝзңҒе’ёйҳіеёӮпјү
- жІӘ科зүҲеҢ–еӯҰжӢ“еұ•жҖ§иҜҫзЁӢ1гҖҠеҺҹеӯҗз»“жһ„дёҺе…ғзҙ е‘ЁжңҹеҫӢгҖӢжөӢиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- 2021е№ҙзҰҸе»әзңҒжҷ®йҖҡй«ҳдёӯеӯҰдёҡж°ҙе№ійҖүжӢ©жҖ§иҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2018-2019е№ҙй«ҳдёҖдёҠеӯҰжңҹжңҹжң«жЁЎеқ—иҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲеұұдёңзңҒж—Ҙз…§еёӮпјү
- жөҺе®ҒеёӮй«ҳдәҢеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·иҜ•еҚ·е®Ңж•ҙзүҲ