2018з”ҳиӮғй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺдёҖе®ҡжё©еәҰе’ҢеҺӢејәдёӢпјҢеҗ„з§Қж°”жҖҒзү©иҙЁдҪ“з§Ҝзҡ„еӨ§е°Ҹдё»иҰҒз”ұжһ„жҲҗж°”дҪ“зҡ„еҲҶеӯҗеӨ§е°ҸеҶіе®ҡ BпјҺдёҖе®ҡжё©еәҰе’ҢеҺӢејәдёӢпјҢеҗ„з§Қж°”жҖҒзү©иҙЁдҪ“з§Ҝзҡ„еӨ§е°Ҹдё»иҰҒз”ұжһ„жҲҗж°”дҪ“зҡ„еҲҶеӯҗж•°еҶіе®ҡ CпјҺдёҚеҗҢзҡ„ж°”дҪ“пјҢиӢҘдҪ“з§ҜдёҚеҗҢпјҢе®ғ们жүҖеҗ«зҡ„еҲҶеӯҗж•°дёҖе®ҡдёҚеҗҢ DпјҺеҗҢжё©еҗҢеҺӢдёӢпјҢеҗҢдҪ“з§Ҝзҡ„д»»дҪ•ж°”дҪ“еҚ•иҙЁжүҖеҗ«зҡ„еҺҹеӯҗж•°зӣёеҗҢ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еҒҮиӢҘдҪ жҳҜеҚ«з”ҹйҳІз–«дәәе‘ҳпјҢдёәй…ҚеҲ¶0.01 molВ·LпјҚ1зҡ„KMnO4ж¶ҲжҜ’ж¶ІпјҢдёӢеҲ—ж“ҚдҪңеҜјиҮҙжүҖй…Қжә¶ж¶Іжө“еәҰеҒҸй«ҳзҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҸ–KMnO4ж ·е“Ғж—¶дёҚж…ҺеңЁиЎЁйқўжІҫдәҶзӮ№и’ёйҰҸж°ҙ BпјҺжә¶и§Јжҗ…жӢҢж—¶жңүж¶ІдҪ“йЈһжә…еҮә CпјҺе®ҡе®№ж—¶дҝҜи§Ҷе®№йҮҸ瓶еҲ»еәҰзәҝ DпјҺж‘ҮеҢҖеҗҺи§Ғж¶ІйқўдёӢйҷҚпјҢеҶҚеҠ ж°ҙиҮіеҲ»еәҰзәҝ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҢжё©еҗҢеҺӢдёӢпјҢзӯүдҪ“з§Ҝзҡ„дёӨе®№еҷЁеҶ…еҲҶеҲ«е……ж»Ўз”ұ14NгҖҒ13CгҖҒ18Oдёүз§ҚеҺҹеӯҗжһ„жҲҗзҡ„дёҖж°§еҢ–ж°®е’ҢдёҖж°§еҢ–зўіпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( AпјҺжүҖеҗ«еҲҶеӯҗж•° BпјҺеҗ«жңүзӣёеҗҢзҡ„еҲҶеӯҗж•°е’Ңз”өеӯҗж•° CпјҺеҗ«жңүзӣёеҗҢзҡ„иҙЁеӯҗж•°е’Ңдёӯеӯҗж•° DпјҺеҗ«жңүзӣёеҗҢж•°зӣ®зҡ„дёӯеӯҗгҖҒеҺҹеӯҗе’ҢеҲҶеӯҗ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
зү©иҙЁеҲҶзұ»зҡ„дҫқжҚ®йҖҡеёёжңүз»„жҲҗе’ҢжҖ§иҙЁгҖӮдёӢеҲ—зү©иҙЁеҲҶзұ»дёӯпјҢеҸӘиҖғиҷ‘з»„жҲҗзҡ„жҳҜ(гҖҖ гҖҖ) AпјҺNa2SO4жҳҜй’ зӣҗгҖҒзЎ«й…ёзӣҗгҖҒжӯЈзӣҗВ В В В В В В В В В BпјҺHNO3жҳҜдёҖе…ғй…ёгҖҒејәй…ёгҖҒжҢҘеҸ‘жҖ§й…ё CпјҺMg(OH)2жҳҜдәҢе…ғзўұгҖҒйҡҫжә¶жҖ§зўұгҖҒдёӯејәзўұВ В DпјҺAl2O3жҳҜдёӨжҖ§ж°§еҢ–зү©гҖҒйҮ‘еұһж°§еҢ–зү©гҖҒжңҖй«ҳд»·ж°§еҢ–зү©
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ҹдә§з”ҹжҙ»дёӯзҡ„и®ёеӨҡзҺ°иұЎжҲ–еә”з”ЁйғҪдёҺеҢ–еӯҰзҹҘиҜҶжңүе…ігҖӮдёӢеҲ—зҺ°иұЎжҲ–еә”з”ЁдёҺиғ¶дҪ“жҖ§иҙЁж— е…ізҡ„жҳҜ AпјҺе°ҶзӣҗеҚӨжҲ–зҹіиҶҸеҠ е…ҘиұҶжөҶдёӯпјҢеҲ¶жҲҗиұҶи…җ BпјҺеҶ¶йҮ‘еҺӮеёёз”Ёй«ҳеҺӢз”өйҷӨеҺ»зғҹе°ҳпјҢжҳҜеӣ дёәзғҹе°ҳеҫ®зІ’еёҰз”өиҚ· CпјҺжіЎжІ«зҒӯзҒ«еҷЁдёӯе°ҶAl2(SO4)3дёҺNaHCO3жә¶ж¶Іж··еҗҲеҗҺпјҢе–·еҮәеӨ§йҮҸжіЎжІ«пјҢиө·еҲ°зҒӯзҒ«дҪңз”Ё DпјҺжё…жҷЁпјҢдәә们з»ҸеёёиғҪзңӢеҲ°йҳіе…үз©ҝиҝҮиҢӮеҜҶзҡ„ж ‘жңЁжһқеҸ¶жүҖдә§з”ҹзҡ„зҫҺдёҪжҷҜиұЎ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеұһдәҺзәҜеҮҖзү©зҡ„жҳҜ(гҖҖ гҖҖ) в‘ з”ұеҗҢз§Қе…ғзҙ з»„жҲҗзҡ„зү©иҙЁгҖҖв‘Ўе…·жңүеӣәе®ҡзҶ”жІёзӮ№зҡ„зү©иҙЁгҖҖв‘ўз”ұзӣёеҗҢз§Қзұ»е’ҢзӣёеҗҢж•°зӣ®зҡ„еҺҹеӯҗз»„жҲҗзҡ„еҲҶеӯҗгҖҖв‘ЈеҸӘжңүдёҖз§Қе…ғзҙ зҡ„йҳізҰ»еӯҗе’ҢеҸҰдёҖз§Қе…ғзҙ зҡ„йҳҙзҰ»еӯҗз»„жҲҗзҡ„зү©иҙЁгҖҖв‘ӨеңЁж°§ж°”дёӯзҮғзғ§еҸӘз”ҹжҲҗдәҢж°§еҢ–зўізҡ„зү©иҙЁгҖҖв‘ҘеҸӘеҗ«жңүдёҖз§ҚеҲҶеӯҗзҡ„зү©иҙЁ AпјҺв‘Ўв‘ўв‘ҘВ В В В В В В В В BпјҺв‘Јв‘Өв‘ҘВ В В В В В В В CпјҺв‘ в‘ЈВ В В В В В В В В DпјҺв‘Ўв‘Ҙ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖ гҖҖ) AпјҺйҳізҰ»еӯҗеҸӘжңүж°§еҢ–жҖ§пјҢйҳҙзҰ»еӯҗеҸӘжңүиҝҳеҺҹжҖ§ BпјҺеӨұз”өеӯҗйҡҫзҡ„еҺҹеӯҗиҺ·еҫ—з”өеӯҗзҡ„иғҪеҠӣдёҖе®ҡејә CпјҺеҫ—еҲ°з”өеӯҗи¶ҠеӨҡзҡ„ж°§еҢ–еүӮпјҢе…¶ж°§еҢ–жҖ§е°ұи¶Ҡејә DпјҺиҰҒе®һзҺ°Fe2пјӢеҲ°Fe3пјӢзҡ„иҪ¬еҢ–пјҢеҝ…йЎ»еҠ е…Ҙж°§еҢ–еүӮ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
зү©иҙЁR2CO3зҡ„йҘұе’Ңжә¶ж¶ІV mLпјҢеҜҶеәҰдёәПҒ gВ·cmпјҚ3пјҢc(RпјӢ)пјқP molВ·LпјҚ1пјҢжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёәa%пјҢжә¶иҙЁзҡ„ж‘©е°”иҙЁйҮҸдёәM gВ·molпјҚ1пјҢжә¶иҙЁзҡ„жә¶и§ЈеәҰдёәS gгҖӮеҲҷдёӢеҲ—иЎЁиҫҫејҸжӯЈзЎ®зҡ„жҳҜ AпјҺaпјқ CпјҺPпјқ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘжҹҗзү©иҙЁXиғҪеҸ‘з”ҹеҰӮдёӢиҪ¬еҢ–пјҡ AпјҺиӢҘXдёәN2жҲ–NH3пјҢеҲҷAдёәзЎқй…ёВ В В В В В В В В В В В BпјҺиӢҘXдёәSжҲ–H2SпјҢеҲҷAдёәзЎ«й…ё CпјҺиӢҘXдёәйқһйҮ‘еұһеҚ•иҙЁжҲ–йқһйҮ‘еұһж°ўеҢ–зү©пјҢеҲҷAдёҚдёҖе®ҡиғҪдёҺйҮ‘еұһй“ңеҸҚеә”з”ҹжҲҗY DпјҺеҸҚеә”в‘ е’Ңв‘ЎдёҖе®ҡдёәж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢеҸҚеә”в‘ўдёҖе®ҡдёәйқһж°§еҢ–иҝҳеҺҹеҸҚеә”
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖ гҖҖ) AпјҺж №жҚ®еҸҚеә”CuпјӢH2SO4 BпјҺеңЁеҸҚеә”CaH2пјӢ2H2O===Ca(OH)2пјӢ2H2вҶ‘дёӯпјҢж°ҙдҪңж°§еҢ–еүӮ CпјҺеҸҚеә”3NO2пјӢH2O===2HNO3пјӢNOдёӯж°§еҢ–еүӮе’ҢиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜ3вҲ¶1 DпјҺCl2зҡ„ж°§еҢ–жҖ§ејәдәҺI2зҡ„ж°§еҢ–жҖ§пјҢж•…зҪ®жҚўеҸҚеә”I2пјӢ2NaClO3===2NaIO3пјӢCl2дёҚиғҪеҸ‘з”ҹ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁT в„ғж—¶пјҢе°Ҷa g NH3е®Ңе…Ёжә¶дәҺж°ҙпјҢеҫ—еҲ°V mLжә¶ж¶ІпјҢеҒҮи®ҫиҜҘжә¶ж¶Ізҡ„еҜҶеәҰдёәПҒ gВ·cmпјҚ3пјҢжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёәwпјҢзү©иҙЁзҡ„йҮҸжө“еәҰдёәc molВ·LпјҚ1пјҢеҲҷдёӢеҲ—йҖүйЎ№дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖ гҖҖ) AпјҺжә¶иҙЁзҡ„иҙЁйҮҸеҲҶж•°дёәwпјқ BпјҺз”Ёж°ҙзЁҖйҮҠиҜҘжә¶ж¶ІпјҢOHпјҚзҡ„зү©иҙЁзҡ„йҮҸеўһеҠ CпјҺиҜҘжә¶ DпјҺдёҠиҝ°жә¶ж¶ІдёӯеҶҚеҠ е…ҘV
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁзЎ«й…ёй“Ғз”өеҢ–жөёеҮәй»„й“ңзҹҝзІҫзҹҝе·ҘиүәдёӯпјҢжңүдёҖдё»иҰҒеҸҚеә”пјҡ CuFeS2пјӢ4Fe3пјӢ===Cu2пјӢпјӢ5Fe2пјӢпјӢ2S еҸҚеә”з»“жқҹеҗҺпјҢз»ҸеӨ„зҗҶиҺ·еҫ—еҚ•иҙЁзЎ«x molгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В В ) AпјҺеҸҚеә”дёӯзЎ«е…ғзҙ иў«ж°§еҢ–пјҢжүҖжңүй“Ғе…ғзҙ еқҮиў«иҝҳеҺҹ BпјҺж°§еҢ–еүӮжҳҜFe3пјӢпјҢж°§еҢ–дә§зү©жҳҜCu2пјӢ CпјҺеҸҚеә”дёӯиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸдёәx mol DпјҺеҸҚеә”з»“жқҹеҗҺпјҢжөӢеҫ—жә¶ж¶Ідёӯдёүз§ҚйҮ‘еұһзҰ»еӯҗзҡ„жҖ»зү©иҙЁзҡ„йҮҸдёәy molпјҢеҲҷеҺҹFe3пјӢзҡ„жҖ»зү©иҙЁзҡ„йҮҸдёә(yпјҚx) mol
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠ100 mLеҗ«жңүMgSO4е’ҢK2SO4зҡ„ж··еҗҲжә¶ж¶ІеҲҶжҲҗдёӨзӯүд»ҪпјҢдёҖд»ҪеҠ е…Ҙеҗ« AпјҺ20(2bпјҚa) molВ·LпјҚ1 BпјҺ20(bпјҚ2a) molВ·LпјҚ1 CпјҺ10(2bпјҚa) molВ·LпјҚ1 DпјҺ10(bпјҚ2a) mol
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||
|
ж №жҚ®иЎЁдёӯдҝЎжҒҜпјҢеҲӨж–ӯдёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖ гҖҖ)
AпјҺз”ұиЎЁдёӯв‘ з»„зҡ„дҝЎжҒҜеҸҜзҹҘйҖҡе…ҘCl2зҡ„йҮҸдёҚеҗҢпјҢж°§еҢ–дә§зү©еҸҜиғҪдёҚеҗҢ BпјҺеҸҚеә”в‘ дёӯпјҢеҪ“еҸӘжңүе°‘йҮҸCl2ж—¶пјҢеҸҚеә”еҸҜиЎЁзӨәдёәCl2пјӢ Fe2пјӢ===Fe3пјӢпјӢ 2ClпјҚ CпјҺиЎЁдёӯв‘Ўз»„еҸҚеә”зҡ„иҝҳеҺҹдә§зү©жҳҜKClпјҢз”өеӯҗиҪ¬з§»ж•°зӣ®жҳҜ6eпјҚ DпјҺиЎЁдёӯв‘ўз»„еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә2MnO
|
|||||||||||||||||||||||||
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗз»„дёҖе®ҡ AпјҺз”Іеҹәж©ҷе‘Ҳй»„иүІзҡ„жә¶ж¶ІдёӯпјҡIпјҚгҖҒClпјҚгҖҒNO BпјҺзҹіи•Ҡе‘Ҳи“қиүІзҡ„жә¶ж¶ІдёӯпјҡNaпјӢгҖҒAlO CпјҺеҗ«еӨ§йҮҸAl3пјӢзҡ„жә¶ж¶ІдёӯпјҡKпјӢгҖҒNO DпјҺеҗ«еӨ§йҮҸOHпјҚзҡ„жә¶ж¶ІдёӯпјҡCO
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іNaClOе’ҢNaClж··еҗҲжә¶ AпјҺиҜҘжә¶ж¶ІдёӯпјҢHпјӢгҖҒNH BпјҺиҜҘжә¶ж¶ІдёӯпјҢAgпјӢгҖҒKпјӢгҖҒNO CпјҺеҗ‘иҜҘжә¶ж¶Ідёӯж»ҙе…Ҙе°‘йҮҸFeSO4жә¶ж¶ІпјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡ 2Fe2пјӢпјӢClOпјҚпјӢ2HпјӢ===ClпјҚпјӢ2Fe3пјӢпјӢH2O DпјҺеҗ‘иҜҘжә¶ж¶ІдёӯеҠ е…Ҙжө“зӣҗй…ёпјҢжҜҸдә§з”ҹ1 mol Cl2пјҢиҪ¬з§»з”өеӯҗзәҰдёә6.02Г—1023дёӘ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дёӢеҲ—еҸҚеә”пјҡв‘ NH4HCO3жә¶ж¶ІдёҺзҹізҒ°ж°ҙеҸҚеә”гҖҒв‘ЎK2SO3жә¶ж¶ІдёҺзЁҖзӣҗй…ёеҸҚеә”пјҢв‘ўSiдёҺзғ§зўұжә¶ж¶ІеҸҚеә”гҖҒв‘ЈFeдёҺзЁҖзЎқй…ёеҸҚеә”пјҢж”№еҸҳеҸҚеә”зү©з”ЁйҮҸпјҢдёҚиғҪз”ЁеҗҢдёҖдёӘзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәзҡ„жҳҜ(гҖҖ гҖҖ) AпјҺв‘ в‘Ўв‘ўгҖҖгҖҖВ В В В В В В В В В В В В В В В В В BпјҺв‘ в‘Ўв‘Ј CпјҺв‘ в‘ўв‘ЈВ В В В В В В В В В В В В В В В В В В В В В DпјҺв‘Ўв‘ўв‘Ј
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
иӢҘ(NH4)2SO4еңЁејәзғӯж—¶еҲҶи§Јзҡ„дә§зү©жҳҜSO2гҖҒN2гҖҒNH3е’ҢH2OпјҢеҲҷиҜҘеҸҚеә”дёӯеҢ–еҗҲд»·еҸ‘з”ҹеҸҳеҢ–е’ҢжңӘеҸ‘з”ҹеҸҳеҢ–зҡ„NеҺҹеӯҗж•°д№ӢжҜ”дёә(гҖҖ гҖҖ) AпјҺ1вҲ¶4В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺ1вҲ¶2 CпјҺ2вҲ¶1В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺ4вҲ¶1
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—ж №жҚ®е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎжүҖеҫ—еҮәзҡ„з»“и®әжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
|
|||||||||||||||||||||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҘдёӢе…ӯз§ҚйҘұе’Ңжә¶ж¶Ів‘ Ba(NO3)2В в‘ЎCa(OH)2В в‘ўNa2SiO3В в‘ЈNaAlO2В в‘ӨNa2CO3В В В в‘Ҙ NH3е’ҢNaClпјҢеҲҶеҲ«жҢҒз»ӯйҖҡе…ҘCO2пјҢжңҖз»Ҳеҫ—еҲ°жІүж·ҖжҲ–жһҗеҮәжҷ¶дҪ“зҡ„жҳҜ (гҖҖгҖҖ) AпјҺв‘ в‘ўв‘Јв‘ҘВ В В В В В В В BпјҺв‘Ўв‘ўв‘Јв‘ҘВ В В В В В В В CпјҺв‘ўв‘Јв‘Өв‘ҘВ В В В В В В DпјҺв‘Ўв‘ўв‘Јв‘Ө
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
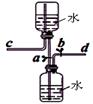
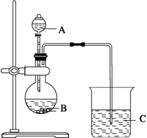
еҸіеӣҫжҳҜжҹҗеҗҢеӯҰи®ҫи®Ўзҡ„еӮЁж°”иЈ…зҪ®пјҲеӣәе®ҡиЈ…зҪ®е·Із•ҘеҺ»пјүпјҢдёӢеҲ—иҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ)
BпјҺж°”дҪ“иў«еӮЁеӯҳеңЁдёӢйқўзҡ„йӣҶ气瓶йҮҢж—¶пјҢcеҜјз®Ўд№ҹеҝ…йЎ»е®үиЈ…жӯўж°ҙеӨ№ CпјҺеҸ–з”ЁеӮЁеӯҳеңЁдёӢйқўйӣҶ气瓶йҮҢзҡ„ж°”дҪ“ж—¶пјҢйҖҡиҝҮжҺ§еҲ¶жӯўж°ҙеӨ№aгҖҒbпјҢеҸҜе°Ҷж°”дҪ“йЎәеҲ©жҺ’еҮә В DпјҺиҜҘиЈ…зҪ®д№ҹеҸҜдҪңдёәеҲ¶еҸ–дәҢж°§еҢ–зўіж°”дҪ“зҡ„еҸ‘з”ҹиЈ…зҪ®
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
зҫҺеӣҪвҖңжө·зӢјвҖқжҪңиүҮдёҠзҡ„ж ёеҸҚеә”е ҶеҶ…дҪҝз”ЁдәҶж¶ІдҪ“й“қй’ еҗҲйҮ‘(еҚ•иҙЁй’ е’ҢеҚ•иҙЁй“қзҶ”еҗҲиҖҢжҲҗ)дҪңиҪҪзғӯд»ӢиҙЁпјҢжңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ) AпјҺеҗҲйҮ‘зҡ„зҶ”зӮ№дёҖиҲ¬жҜ”з»„еҲҶйҮ‘еұһдҪҺ BпјҺй“қй’ еҗҲйҮ‘иӢҘжҠ•е…ҘдёҖе®ҡйҮҸзҡ„ж°ҙдёӯеҸҜеҫ—ж— иүІжә¶ж¶ІпјҢеҲҷn(Al)вүӨn(Na) CпјҺй“қй’ еҗҲйҮ‘жҠ•е…ҘеҲ°и¶ійҮҸж°ҜеҢ–й“ңжә¶ж¶ІдёӯпјҢдјҡжңүж°ўж°§еҢ–й“ңжІүж·Җд№ҹеҸҜиғҪжңүй“ңжһҗеҮә DпјҺиӢҘm gдёҚеҗҢз»„жҲҗзҡ„й“қй’ еҗҲйҮ‘жҠ•е…Ҙи¶ійҮҸзӣҗй…ёдёӯпјҢж”ҫеҮәзҡ„H2и¶ҠеӨҡпјҢеҲҷй“қзҡ„иҙЁйҮҸеҲҶж•°и¶Ҡе°Ҹ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
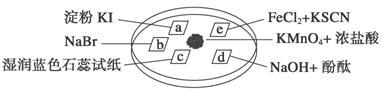
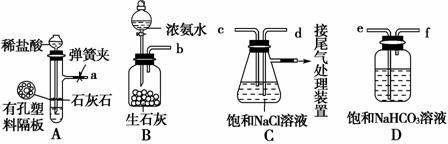
дёӢеӣҫжүҖзӨәжҳҜйӘҢиҜҒж°Ҝж°”жҖ§иҙЁзҡ„еҫ®еһӢе®һйӘҢпјҢaгҖҒbгҖҒdгҖҒeжҳҜжөёжңүзӣёе…іжә¶ж¶Ізҡ„ж»ӨзәёгҖӮеҗ‘KMnO4жҷ¶дҪ“ж»ҙеҠ дёҖж»ҙжө“зӣҗй…ёеҗҺпјҢз«ӢеҚіз”ЁеҸҰдёҖеҹ№е…»зҡҝжүЈеңЁдёҠйқўгҖӮ е·ІзҹҘпјҡ2KMnO4пјӢ16HClвҖ•вҶ’2KClпјӢ5Cl2вҶ‘пјӢ2MnCl2пјӢ8H2O
еҜ№е®һйӘҢзҺ°иұЎзҡ„вҖңи§ЈйҮҠжҲ–з»“и®әвҖқжӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ)
|
||||||||||||||||
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ (гҖҖгҖҖ) AпјҺжө“зӣҗй…ёеңЁеҢ–еӯҰеҸҚеә”дёӯж—ўеҸҜд»ҘдҪңж°§еҢ–еүӮпјҢеҸҲеҸҜд»ҘдҪңиҝҳеҺҹеүӮ BпјҺе·ҘдёҡдёҠеёёд»ҘSiO2дёәеҺҹж–ҷеҲ¶еҸ–зІ—зЎ…пјҢиҝҷдёҖиҝҮзЁӢдёӯпјҢзЎ…е…ғзҙ иў«ж°§еҢ– CпјҺеңЁд»»дҪ•жқЎд»¶дёӢйғҪдёҚиғҪеҸ‘з”ҹеҸҚеә”:Cu + H2SO4пјқCuSO4+ H2вҶ‘ D
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе®№еҷЁдёӯеҸ‘з”ҹдёҖдёӘеҢ–еӯҰеҸҚеә”пјҢеҸҚеә”иҝҮзЁӢдёӯеӯҳеңЁH2OгҖҒClOпјҚгҖҒCNпјҚгҖҒHCO
BпјҺж°§еҢ–еүӮжҳҜClOпјҚпјҢиҝҳеҺҹдә§зү©жҳҜHCO CпјҺй…Қе№іеҗҺж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„и®ЎйҮҸж•°д№ӢжҜ”дёә5вҲ¶2 DпјҺж ҮеҮҶзҠ¶еҶөдёӢиӢҘз”ҹжҲҗ2.24 L N2пјҢеҲҷиҪ¬з§»з”өеӯҗ0.5 mol
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
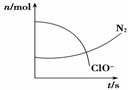
жҹҗдёҖеҸҚеә”дҪ“зі»дёӯж¶үеҸҠзҡ„еҸҚеә”зү©е’Ңз”ҹжҲҗзү©е…ұжңү4з§Қзү©иҙЁпјҡXгҖҒCl2гҖҒNH3гҖҒN2гҖӮеҪ“иҪ¬з§»зҡ„з”өеӯҗжҖ»ж•° aдёӘж—¶пјҢж°®ж°”ж•°йҮҸеҸҳеҢ–дәҶb molгҖӮ (1)ж°§еҢ–дә§зү©зҡ„ж‘©е°”иҙЁйҮҸжҳҜ________________гҖӮ (2)йҳҝдјҸеҠ еҫ·зҪ—еёёж•°дёә(з”Ёеҗ«aгҖҒbзҡ„д»Јж•°ејҸиЎЁзӨә)______________гҖӮ (3)XеҸҜиғҪжңүдёӨз§Қз»„жҲҗпјҡHClжҲ–NH4ClпјҢдёәзЎ® в‘ иӢҘе®һйӘҢз»“жһң(з”ЁV1гҖҒV2дёҺV3й—ҙе…ізі»жқҘиЎЁзӨәпјҢдёӢеҗҢ)жҳҜ________________________ в‘ЎиӢҘе®һйӘҢз»“жһңжҳҜ__________________пјҢеҲҷXзҡ„еҢ–еӯҰејҸдёәNH4ClгҖӮ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ«гҖҒж°Ҝзҡ„еҚ•иҙЁе’ҢеҢ–еҗҲзү©еә”з”Ёе№ҝжіӣгҖӮ (1)е°ҶзЎ«й“Ғзҹҝе’Ңз„ҰзӮӯжҢүзү©иҙЁзҡ„йҮҸжҜ”3вҲ¶2ж··еҗҲж”ҫеңЁзӮјзЎ«зӮүдёӯпјҢйҖҡе…ҘйҖӮйҮҸз©әж°”дёӯпјҢеҸ‘з”ҹдёӢеҲ—зҮғзғ§еҸҚеә”пјҡFeS2пјӢCпјӢO2вҖ•вҶ’Fe3O4пјӢCOпјӢSгҖӮ иҜ·й…Қе№ідёҠиҝ°еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸпјҡ________________________________________________гҖӮ з”ҹжҲҗ3 molзЎ«пјҢиў«ж°§еҢ–зү©иҙЁзҡ„зү©иҙЁзҡ„йҮҸдёә________________гҖӮ (2)зӣҗй…ёжҳҜеә”з”Ёе№ҝжіӣзҡ„й…ёд№ӢдёҖпјҢе®ғе…·жңүпјҡa.й…ёжҖ§пјӣb.ж°§еҢ–жҖ§пјӣc.иҝҳеҺҹжҖ§пјӣd.жҢҘеҸ‘жҖ§гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ жө“зӣҗй…ёй•ҝж—¶й—ҙйңІзҪ®еңЁз©әж°”дёӯпјҢжә¶ж¶Ізҡ„иҙЁйҮҸеҮҸиҪ»пјҢзӣҗй…ёиЎЁзҺ°дәҶ________(еЎ«еәҸеҸ·)гҖӮ в‘Ўе®һйӘҢе®Өз”ЁзЁҖзӣҗй…ёе’Ңй”ҢзІ’еҸҚеә”еҲ¶еҸ–ж°ўж°”пјҢзӣҗй…ёиЎЁзҺ°дәҶ________(еЎ«еәҸеҸ·) в‘ўз”Ёзӣҗй…ёйҷӨеҺ»й“ҒиЎЁйқўзҡ„й“Ғй”ҲпјҢзӣҗй…ёиЎЁзҺ°дәҶ________(еЎ«еәҸеҸ·) (3)е®һйӘҢе®ӨеҸҜз”ЁиҪҜй”°зҹҝ(дё»иҰҒжҲҗеҲҶдёәMnO2)еҲ¶еӨҮKMnO4пјҢе…¶еҺҹзҗҶеҰӮдёӢпјҡй«ҳжё©дёӢпјҢзҶ”иһҚзҡ„иҪҜй”°зҹҝдёҺиҝҮйҮҸеӣәдҪ“KOHеҸҚеә”еңЁдёҚж–ӯйҖҡе…Ҙз©әж°”зҡ„жғ…еҶөдёӢдјҡеҸҚеә”з”ҹжҲҗK2MnO4(й”°й…ёй’ҫ)пјӣз”Ёж°ҙжә¶и§ЈпјҢж»ӨеҺ»ж®ӢжёЈпјӣй…ёеҢ–ж»Өж¶ІпјҢK2MnO4иҪ¬еҢ–дёәMnO2е’ҢKMnO4пјӣеҶҚж»ӨеҺ»жІүж·ҖMnO2пјҢжө“зј©ж»Өж¶ІпјҢеҫ—еҲ°ж·ұзҙ«иүІзҡ„й’ҲзҠ¶KMnO4жҷ¶дҪ“гҖӮ в‘ з”ЁиҪҜй”°зҹҝеҲ¶еӨҮK2MnO4зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ _________________________________________________________________ в‘ЎиӢҘз”Ё5 gиҪҜй”°зҹҝ(MnO2зҡ„иҙЁйҮҸеҲҶж•°дёә70%)иҝӣиЎҢдёҠиҝ°е®һйӘҢпјҢеҲҷKMnO4зҡ„зҗҶи®әдә§йҮҸдёә________ g(зІҫзЎ®еҲ°0.01пјҢдёҚиҖғиҷ‘MnO2жІүж·Җзҡ„еҫӘзҺҜеҲ©з”Ё)гҖӮ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
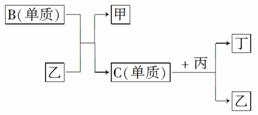
зҺ°жңүAгҖҒBгҖҒCгҖҒDеӣӣз§Қзҹӯе‘Ё
(1)еҶҷеҮәBпјӢд№ҷвҖ•вҶ’з”ІпјӢCзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸ _________________________________________________________________гҖӮ (2)ж №жҚ®д»ҘдёҠжқЎд»¶еҸҜд»ҘзЎ®е®ҡAгҖҒBгҖҒCгҖҒDеӣӣз§Қе…ғзҙ дёӯзҡ„дёүз§ҚпјҢдёҚиғҪиў«зЎ®е®ҡзҡ„第еӣӣз§Қе…ғзҙ жҳҜ________(еЎ«еҶҷеәҸеҸ·)гҖӮ в‘ AгҖҖгҖҖгҖҖгҖҖв‘ЎBгҖҖгҖҖгҖҖгҖҖв‘ўCгҖҖгҖҖгҖҖгҖҖв‘ЈD (3)дҫқжҚ®дёӢеҲ—жқЎд»¶еҸҜд»ҘиҝӣдёҖжӯҘзЎ®е®ҡдёҠиҝ°з¬¬еӣӣз§Қе…ғзҙ пјҡ в‘ з”ІдёҺдёҷд»ҘеҸҠд№ҷдёҺдёҷеқҮиғҪеӨҹеҸ‘з”ҹеҸҚеә”пјҢв‘Ўз”ІгҖҒдёҷйғҪжҳҜж— иүІгҖҒжңү жҚ®жӯӨпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ еҶҷеҮәдёҠиҝ°з¬¬еӣӣз§Қе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ® _________________________________________________________________гҖӮ еҶҷеҮәCпјӢдёҷвҖ•вҶ’д№ҷпјӢдёҒзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸ _________________________________________________________________гҖӮ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёи§Ғзҡ„дә”з§ҚзӣҗAгҖҒBгҖҒCгҖҒDгҖҒEпјҢе®ғ们зҡ„йҳізҰ»еӯҗеҸҜиғҪжҳҜNaпјӢгҖҒNH в‘ дә”з§ҚзӣҗеқҮжә¶дәҺж°ҙпјҢж°ҙжә¶ж¶ІеқҮдёәж— иүІ в‘ЎDзҡ„з„°иүІеҸҚеә”е‘Ҳй»„иүІ в‘ўAзҡ„жә¶ж¶Іе‘ҲдёӯжҖ§пјҢBгҖҒCгҖҒEзҡ„жә¶ж¶Іе‘Ҳй…ёжҖ§пјҢDзҡ„жә¶ж¶Іе‘ҲзўұжҖ§ в‘ЈиӢҘеңЁиҝҷдә”з§Қзӣҗзҡ„жә¶ж¶ІдёӯеҲҶеҲ«еҠ е…ҘBa(NO3)2жә¶ж¶ІпјҢеҸӘжңүAгҖҒCзҡ„жә¶ж¶ІдёҚдә§з”ҹжІүж·Җ в‘ӨиӢҘеңЁиҝҷдә”з§Қзӣҗзҡ„жә¶ж¶ІдёӯпјҢеҲҶеҲ«еҠ е…Ҙж°Ёж°ҙпјҢEе’ҢCзҡ„жә¶ж¶Ідёӯз”ҹжҲҗжІүж·ҖпјҢ继з»ӯеҠ ж°Ёж°ҙпјҢCдёӯжІүж·Җж¶ҲеӨұ в‘ҘжҠҠAзҡ„жә¶ж¶ІеҲҶеҲ«еҠ е…ҘеҲ°BгҖҒCгҖҒEзҡ„жә¶ж¶ІдёӯпјҢеқҮиғҪз”ҹжҲҗдёҚжә¶дәҺзЁҖзЎқй…ёзҡ„жІүж·Җ иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)дә”з§ҚзӣҗдёӯпјҢдёҖе®ҡжІЎжңүзҡ„йҳізҰ»еӯҗжҳҜ________пјӣ (2)иҝҷдә”з§ҚзӣҗеҲҶеҲ«жҳҜпјҲеҶҷеҲҶеӯҗејҸпјү В AВ В В В В В В В В В В В В В В В В В BВ В В В В В В В В В В В В В В В В CВ В В В В В В В В В В В В В В В В В DВ В В В В В В В В В В В В В В В В В EВ В В В В В В В В В В В В В В (3)иӢҘиҰҒжЈҖйӘҢBдёӯжүҖеҗ«зҡ„йҳізҰ»еӯҗпјҢжӯЈзЎ®зҡ„е®һйӘҢж–№жі•жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
зўій…ёй’ еңЁиҪ»е·ҘгҖҒе»әжқҗгҖҒзәәз»ҮгҖҒеӣҪйҳІгҖҒеҢ»иҚҜзӯүе·ҘдёҡдёӯжңүйҮҚиҰҒзҡ„
зўій…ёй’ зҡ„йҘұе’Ңжә¶ж¶ІеңЁдёҚеҗҢжё©еәҰдёӢжһҗеҮәзҡ„жә¶иҙЁеҰӮеӣҫжүҖзӨәпјҡ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ иҜ•еүӮAжҳҜ________пјҢвҖңжҜҚж¶ІвҖқдёӯйҷӨдәҶеҗ«жңүNaпјӢгҖҒCO в‘ЎжЈҖйӘҢиҜ•еүӮзә§Na2CO3дёӯClпјҚе’ҢSO aпјҺHClгҖҒBaCl2гҖҒAgNO3 bпјҺAgNO3гҖҒHNO3гҖҒBa(NO3)2 cпјҺHNO3гҖҒBa(NO3)2гҖҒAgNO3 dпјҺAgNO3гҖҒHClгҖҒBaCl2 (2)вҖңдҫҜж°ҸеҲ¶зўұжі•вҖқзҡ„еҺҹзҗҶпјҡ NaClпјӢNH3пјӢCO2пјӢH2O===NaHCO3вҶ“пјӢNH4Cl еҰӮеӣҫжҳҜжҹҗе…ҙи¶Је°Ҹз»„еңЁе®һйӘҢе®ӨдёӯжЁЎжӢҹвҖңдҫҜж°ҸеҲ¶зўұжі•вҖқеҲ¶еҸ–NaHCO3жүҖз”ЁеҲ°зҡ„дё»иҰҒиЈ…зҪ®гҖӮ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ еҗ„д»ӘеҷЁеҸЈзҡ„иҝһжҺҘйЎәеәҸдёәaжҺҘ________пјҢ________жҺҘ________пјҢ________жҺҘbпјҢе®һйӘҢж—¶е…Ҳеҗ‘NaClжә¶ж¶ІдёӯйҖҡе…ҘиҫғеӨҡзҡ„NH3пјҢеҶҚйҖҡе…Ҙи¶ійҮҸзҡ„CO2пјҢе…¶еҺҹеӣ жҳҜ________(еЎ«еӯ—жҜҚ)гҖӮ aпјҺдҪҝCO2жӣҙжҳ“иў«еҗёж”¶
cпјҺCO2зҡ„еҜҶеәҰжҜ”NH3еӨ§ в‘Ўе°Ҷз”ҹжҲҗзҡ„NaHCO3жҷ¶дҪ“д»Һ в‘ўиҜҘе…ҙи¶Је°Ҹз»„з”ЁеҰӮеӣҫиЈ…зҪ®жҜ”иҫғCгҖҒNгҖҒSiдёүз§Қе…ғзҙ зҡ„йқһйҮ‘еұһжҖ§ејәејұпјҢBдёӯзҡ„иҜ•еүӮжҳҜ________пјҢиғҪиҜҙжҳҺзўізҡ„йқһйҮ‘еұһжҖ§жҜ”зЎ…ејәзҡ„е®һйӘҢзҺ°иұЎжҳҜ_______________________(H2SiO3жҳҜдёҖз§ҚдёҚжә¶дәҺж°ҙзҡ„зҷҪиүІиғ¶зҠ¶зү©)гҖӮ
|
|
- еұұиҘҝй«ҳдәҢеҢ–еӯҰ2019е№ҙдёӢеҶҢжңҹдёӯиҖғиҜ•иҜ•еҚ·е®Ңж•ҙзүҲ
- жөҷжұҹ2020е№ҙй«ҳдёҖеҢ–еӯҰдёӢеҚҠе№ҙжңҲиҖғжөӢйӘҢеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- 2019-2020е№ҙй«ҳдёҖдёҠеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲеұұдёңзңҒж–°жі°дәҢдёӯпјү
- жөҷжұҹй«ҳдәҢеҢ–еӯҰ2019е№ҙдёҠеҚҠе№ҙејҖеӯҰиҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- дә‘еҚ—й«ҳдёҖеҢ–еӯҰжңҹжң«иҖғиҜ•пјҲ2019е№ҙдёӢеӯҰжңҹпјүе®Ңж•ҙиҜ•еҚ·
- 2018-2019е№ҙй«ҳдәҢдёҠеҚҠжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰдё“йўҳи®ӯз»ғпјҲе®үеҫҪзңҒж»Ғе·һеёӮж°‘еҠһй«ҳдёӯпјү
- зҰҸе»әзңҒжјіе·һеёӮе№іе’ҢеҺҝ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ
- 2019-2020й«ҳдёҖдёҠеҶҢжңҹжң«жөӢиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеҗүжһ—зңҒй•ҝжҳҘеёӮд№қеҸ°еҢә第еӣӣдёӯеӯҰпјү