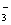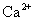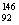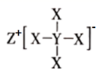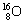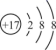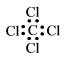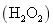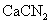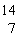高中化学必修一2020-2021学年度——化学键综合复习题(一)含答案解析
| 1. | 详细信息 |
|
X 、 Y 、 Z 、 W 是原子序数依次增大的短周期主族元素。 Y 是同周期元素中非金属性最强的元素, Z 是短周期中金属性最强的元素, W 的单质晶体是应用最广泛的半导体材料, X 原子的最外层电子数等于 Z 、 W 原子最外层电子数之和。下列说法正确的是 A . 原子半径: r(W) > r(Z) > r(X) > r(Y) B . W 、 Z 的最高价氧化物对应水化物之间能反应生成盐和水 C . X 的简单气态氢化物的热稳定性比 Y 强 D . Y 、 Z 组成的化合物中的化学键类型与 Y 、 W 组成的化合物相同 |
|
| 2. | 详细信息 |
|
下列含有共价键和离子键的氧化物是 A . NaOH B . MgO C . Na 2 O D . Na 2 O 2 |
|
| 3. | 详细信息 |
|
下列说法不正确的是 A . 非极性分子中,不一定含有非极性共价键 B . H 2 O 比 H 2 S 稳定是因为水分子间存在氢键 C . 氢氟酸水溶液中氢键的类型有 F—H…F 、 F—H…O 、 O—H…F 、 O—H…O D . |
|
| 4. | 详细信息 |
|
下列说法正确的是 A . 硝酸中含有 H + 和 NO B . X 2 + 的核外电子数目为 18 ,则 X 在第四周期第 Ⅱ A 族 C . 元素周期表有 7 个主族, 7 个副族, 1 个 0 族, 1 个 Ⅷ族,共 16 纵行 D . Na 2 O 2 只含有离子键,它属于离子化合物 |
|
| 5. | 详细信息 |
|
下列有关化学用语表述不正确的是 A . C . N 2 H 4 的结构式: |
|
| 6. | 详细信息 |
|
下列说法正确的是 ① 化学键可以存在于原子之间也可以存在于分子之间 ② 化学键断裂,不一定发生化学变化 ③ 物质中一定存在化学键 ④ 两种非金属元素形成的化合物可能含离子键 ⑤ 离子化合物可能含有共价键 ⑥ 共价化合物中可能有离子键 A . ①②③ B . ②④⑤ C . ②⑤ D . ①②⑤ |
|
| 7. | 详细信息 |
|
下列关于化学用语的表示正确的是 A . 过氧化钠的电子式: C . C 60 和石墨互为同位素 D . 具有 10 个中子的氧原子: |
|
| 8. | 详细信息 |
|
下列化学用语表示正确的是 A . H 2 O 2 的电子式: C . 原子核内有 8 个中子的碳原子: |
|
| 9. | 详细信息 |
|
下列有关化学用语表示正确的是 A . CO 2 的结构式: C = O = O B . 氢氧根离子的电子式: C . 氯原子的结构示意图: D . 中子数为 146 、质子数为 92 的铀 ( U )原子: |
|
| 10. | 详细信息 |
|
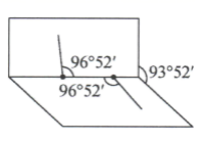
如图所示化合物是一种常见的储氢材料,其中 X 、 Y 、 Z 为原子序数依次增大的短周期主族元素,且 X 、 Y 、 Z 处于不同周期。下列叙述错误的是 A . Z + 为 10 电子微粒 B . Z 与 X 可形成离子化合物 ZX C . 原子半径: Z>Y D . Y 的最高价氧化物的水化物是二元弱酸 |
|
| 11. | 详细信息 |
|
下列说法正确的是 A . 离子化合物中一定含有离子键,不可能含有非极性键 B . 鉴别某化合物是离子化合物还是共价化合物,可以检验它们是否在熔融状态下导电 C . 有化学键断裂或形成的过程一定发生了化学反应 D . NaHSO 4 中阴阳离子个数比为 2 : 1 |
|
| 12. | 详细信息 |
|
N A 为阿伏伽德罗常数,下列说法正确的是 A . 20gD 2 O 含有的中子数为 10N A B . 4.4g 14 CO 2 和 4.4gN 2 O 含有相同的电子数 C . 1.6gN 2 H 4 含有 0.4N A 个极性键 D . 1mol 氦气含有 2N A 个原子 |
|
| 13. | 详细信息 |
|
下列物质中既含有离子键又含有极性键的是 A . NaHSO 4 B . Na 2 O 2 C . KCl D . HF |
|
| 14. | 详细信息 |
|
下列化学用语的表述不正确的是 A . 硫化钠的电子式: B . 用电子式表示 MgF 2 的形成过程: C . D . 中子数为 10 的氧的一个核素: |
|
| 15. | 详细信息 |
|
下列化学基本用语中表示不正确的是 A . CH 4 分子的空间充填模型: B . CO 2 的电子式: C . S 2- 的结构示意图: D . 用电子式表示氯化钠的形成过程: |
|
| 16. | 详细信息 |
|
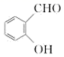
下列有关化学用语表示正确的是 A .乙醇的结构简式: C 2 H 6 O B .乙醛的结构简式: C . Si 原子的结构示意图为 |
|
| 17. | 详细信息 |
|
下列有关化学用语表示正确的是 A . N 2 的电子式: C . 中子数为 10 的氧原子: |
|
| 18. | 详细信息 |
|
食盐是生活中常用的调味品,胃酸的主要成分是盐酸。下列有关说法正确的是 A . 炒菜时放入食盐并不破坏 NaCl 中的化学键 B . 盐酸中存在 H + 和 Cl - ,则 HCl 属于离子化合物 C . 盐酸与浓氨水反应的产物中存在离子化合物 D . NaCl 熔化时破坏共价键 |
|
| 19. | 详细信息 |
|
下列物质中,属于离子化合物的是 A . NH 4 C1 B . H 2 O C . HCl D . CO 2 |
|
| 20. | 详细信息 |
|
下列物质中既含有共价键又含有离子键的是 A . HF B . HCl C . NH 3 D . NaOH |
|
| 21. | 详细信息 |
|
下列既含离子键又含共价键的是 A . NaCl B . HCl C . CO 2 D . Na 2 O 2 |
|
| 22. | 详细信息 |
|
下列物质中既含有离子键又含有共价键的是 A . NaOH B . H 2 O C . NaCl D . KI |
|
| 23. | 详细信息 |
|
下列说法中正确的是 A . 书写共价化合物的电子式只需把结构式中的一个单键改成一对电子即可 B . 化学反应过程中,反应物分子内的化学键断裂、产物分子中的化学键形成 C . 将某种化合物溶于水,若能导电说明这种化合物是离子化合物 D . NH 3 的稳定性很强,是因为其分子间能形成氢键 |
|
| 24. | 详细信息 |
|
下列叙述正确的是 A . 含有非极性键的化合物不一定是共价化合物 B . 两种元素构成的共价化合物中的化学键都是极性键 C . 共价化合物可能含有离子键 D . 离子化合物不可能含有共价键 |
|
| 25. | 详细信息 |
|
下列说法中正确的是 A . CH 4 和 BCl 3 分子中所有原子的最外层都达到了 8 电子稳定结构 B . 原子次外层电子数是最外层电子数 8 倍的元素的最高价氧化物的水化物溶于水一定是强碱溶液 C . 将某种化合物溶于水,若能导电说明这种化合物是离子化合物 D . 氯气与 NaOH 反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
|
| 26. | 详细信息 |
|
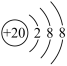
下列说法错误的是 A . 物质 CaHAsO 4 中含有两种长周期元素 B . SiO 2 超分子纳米管中存在共价键 C . D . 离子结构示意图为 |
|
| 27. | 详细信息 |
|
下列物质中只含有离子键的是 A . NH 3 B . NH 4 Cl C . Na 2 O D . H 2 O 2 |
|
| 28. | 详细信息 |
|
下列化学用语正确的是 A . 乙酸分子的比例模型: B . 二氧化碳、二氧化硅的分子式分别为: CO 2 、 SiO 2 C . 质子数为 86 、中子数为 136 的氡原子: D . Mg 和 Cl 形成离子键的过程: |
|
| 29. | 详细信息 |
|
下列表述不正确的是 A . 超导材料 K 3 C 60 在熔融状态下能导电,说明 K 3 C 60 是电解质 B . 2020 年 7 月 31 日我国北斗三号全球卫星导航系统正式开通,北斗卫星运载火箭采用的推进剂有 N 2 O 4 和偏二甲肼 C . ClO 2 泡腾片和酒精均可杀灭新型冠状病毒,但是二者消毒原理并不相同 D . 为测定熔融氢氧化钠的导电性,常将氢氧化钠固体放在石英坩埚中加热熔化 |
|
| 30. | 详细信息 |
|
下列说法中正确的是 A . 分子中键能越大,键长越长,则分子越稳定 B . 元素周期表中 Ⅰ A 族 ( 除 H 外 ) 和 Ⅶ A 族元素的原子间可能形成共价键 C . PCl 3 分子中 P 原子和 Cl 原子最外层都满足 8 电子结构 D . H-O 键键能为 463 kJ/mol ,即 18 g H 2 O 分解成 H 2 和 O 2 时,消耗能量为 2×463 kJ |
|
| 31. | 详细信息 |
|
A 、 B 、 C 、 D 、 E 是五种短周期主族元素,它们的原子序数依次增大。已知: A 的一种原子不含中子; B 原子最外层电子数是次外层的 3 倍; C 与 A 处于同一主族; D 的原子序数是 B 的 2 倍。下列叙述正确的是 A . 在 B 、 D 、 E 形成的简单离子中, E 离子的还原性最强 B . 1 mol E 的单质与 C 最高价氧化物对应水化物的溶液完全反应时,转移 2 mol 电子 C . 最高价氧化物对应水化物的酸性: D > E D . B 与 C 形成的化合物中一定含有离子键,也可能含有共价键 |
|
| 32. | 详细信息 |
|
某离子化合物中,阴离子和阳离子的电子层结构与氖原子的相同,则此离子化合物是 A . NaCl B . H 2 O C . MgO D . CO 2 |
|
| 33. | 详细信息 |
|
下列化学用语表达正确的是 A . 用电子式表示 MgCl 2 的形成过程: B . 37 Cl 的原子结构示意图: C . 中子数为 146 、质子数为 92 的铀 (U) 原子: D . 四氯化碳的电子式 |
|
| 34. | 详细信息 |
|
下列有关化学用语表示正确的是 A . 氮分子的结构式: N—N B . 氢氧化钡的电子式: C . 质量数为 37 的氯原子: |
|
| 35. | 详细信息 |
|
液氨是富氢物质,是氢能的理想载体。下列说法不正确的是 A . NH 3 分子中氮原子的杂化方式为 sp 2 杂化 B . C . 相同压强下, NH 3 的沸点比 PH 3 的沸点低 D . |
|
| 36. | 详细信息 |
|
Cl 2 与 NaOH 溶液反应可生成 NaCl 、 NaClO 和 NaClO 3 (Cl - 和 ClO - 的比值与反应的温度有关 ) ,用 24.0g NaOH 配成的 250mL 溶液,与 Cl 2 恰好完全反应 ( 忽略 Cl 2 与水的反应、盐类的水解及溶液体积变化 ) : (1) 请选出下列物质所含有的化学键类型: Cl 2 : ___________ ; NaOH : ___________ 。 A .离子键 B .共价键 C .氢键 D .分子间作用力 (2) 配制 NaOH 溶液时,除了下列仪器外,还需要用到的玻璃仪器是 ___________ 。 A .烧杯 B .玻璃棒 C .胶头滴管 D .托盘天平 (3) 配得的 NaOH 溶液物质的量浓度为 ___________ 。 (4) 某温度下,反应后溶液中 c (Cl - )=6 c (ClO - ) ,则溶液中 c (ClO - ) = ___________ mol/L |
|
| 37. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下表是元素周期表的一部分,用化学用语回答下列问题:
( 1 )请画出元素⑨阴离子的结构示意图: ___________ 。 ( 2 )②⑥⑦的原子半径由大到小的顺序为 ___________ (填元素符号)。 ( 3 )①-⑨号元素中元素的最高价氧化物对应的水化物中酸性最强的是 ___________ , (用化学式表示),⑤与⑦的最高价氧化物对应水化物反应的化学方程式 ___________ 。 ( 4 )⑥⑨两种元素的原子按 1 : 2 组成的常见化合物的电子式为 ___________ ;元素 ⑤的最高价氧化物对应水化物中含有的化学键类型为 ___________ 。 ( 5 )欲比较③和⑧两种元素的非金属性强弱,可以作为验证的证据是 ___________ (填字母)。 A 比较这两种元素单质的沸点 B 比较这两种元素单质与氢气化合的难易 C 比较这两种元素的最高价氧化物对应水化物的酸性 ( 6 )⑨单质与水反应的离子方程式为 ___________ 。 |
|||||||||||||||||||||||||||||||||||||
| 38. | 详细信息 |
|
(1) 短周期中,金属性最强的元素是 ___________ ( 写元素符号,下同 ) ,非金属性最强的元素是 ___________ ,原子半径最小的元素是 ___________ 。 (2) 寻找所需元素:在 ___________ 区域找到制造半导体材料,如 ___________ ( 写元素符号 ) ; (3) 写出下列物质的电子式: NaOH ___________ ; N 2 ___________ ; Na 2 O 2 ___________ ; CO 2 ___________ ; NH 4 Cl ___________ ; HClO ___________ 。 (4) 现有下列几种微粒: 1 H 、 2 H 、 3 H 、 1 H + 、 234 U 、 235 U 、 238 U 、 40 K 、 40 Ca 、 Cl 2 、 14 N 、 14 C ,以上微粒分别属于 ___________ 种元素,互为同位素的原子分别为 ___________ 、 ___________ 。 |
|
| 39. | 详细信息 |
|
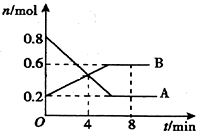
Ⅰ. 现有 6 种物质 ① MgCl 2 ② HCl ③ SO 2 ④ K 2 CO 3 ⑤ CaO ⑥ NaHSO 4 ⑦ N 2 请根据下列标准,对上述物质进行分类 ( 填序号 ) : (1) 属于共价化合物是 ___________ 。 (2) 只含离子键的化合物是 ___________ 。 (3) 含共价键的离子化合物是 ___________ 。 (4) 如果将 NaHSO 4 溶于水,破坏了 NaHSO 4 中化学键的类型为 ___________ 。 Ⅱ. 某温度时,在 0.5L 密闭容器中,某一反应中 A 、 B 气体的物质的量随时间变化的曲线如图所示,回答下列问题: (1) 该反应的化学方程式为 ___________ 。 (2) 第 4min 时,正、逆反应速率的大小关系为: v( 正 ) ___________ v( 逆 ) , ( 填 “ > ”“ < ” 或 “=”) 。 (3) 下列措施能加快反应速率的是 ___________ 。 A .恒温恒容充入 He 气 B .缩小体积,使压强增大 C .恒温恒压充入 He 气 D .使用催化剂 |
|
| 40. | 详细信息 |
|
有以下 8 种物质: ① He ② HCl ③ P 4 ④ H 2 O 2 ⑤ Na 2 S ⑥ NaOH ⑦ Na 2 O 2 ⑧ NH 4 Cl 请用上述做物质的序号填空: 不存在化学键的是 ___________ 只存在共价键的是 ___________ 。 只存在离子键的是 ___________ 既存在离子键又存在共价键的是 ___________ |
|
| 41. | 详细信息 |
|
双氧水 (1) (2) (3) |
|
| 42. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
( 1 ) 11 种元素中,化学性质最不活泼的是 ___________ ,原子半径最小的是 ___________ 。 ( 2 )①②⑤中,最高价氧化物的水化物,碱性最强的是 ___________ 。 ( 3 )②③④中形成的简单离子半径由大到小的顺序是 ___________ 。 ( 4 )元素⑦的简单氢化物电子式为 ___________ 。 ( 5 )①和⑨的最高价氧化物对应的水化物化学式为 ___________ 和 ___________ 。 ①和⑨两元素形成化合物中化学键的类型为 ___________ ,该化合物的溶液与元素 ⑧的单质反应的离子方程式为 ___________ 。 ( 6 )①和⑤最高价氧化物对应的水化物相互反应的化学方程式为 ___________ 。 ( 7 )⑧⑨⑪三种元素形成的气态氢化物最稳定的是 ___________ 。 |
|||||||||||||||||||||||||||||||||||||
| 43. | 详细信息 |
|
按要求填空: Ⅰ:下列物质有 ①N 2 ②CO 2 ③NH 3 ④Na 2 O ⑤Na 2 O 2 ⑥NaOH ⑦CaBr 2 ⑧H 2 O 2 ⑨NH 4 Cl (1) 既含有极性键又含有非极性键的是 ___________ ; ( 填序号,下同 ) (2) 含有非极性键的离子化合物是 ___________ ; (3) 写出 ① 的电子式 ___________ ; Ⅱ: (1) 相同物质的量的 14 CO 2 和 S 18 O 2 的质量之比为 ___________ ;中子数之比为 ___________ ;电子数之比为 ___________ 。 (2) 已知:碳元素有 12 C 、 13 C 、 14 C ;氧元素有 16 O 、 18 O ,则它们能够形成 ___________ 种 CO 2 分子。 (3) |
|
| 44. | 详细信息 | ||||||||||||||||||||||||||||||||
|
如表是元素周期表的一部分。
(1) 表中元素的非金属性最强 ___ ( 填写元素符号,下同 ) ;原子半径最大的是元素 ___ ;其氧化物是两性氧化物的元素是 ___ 。 (2) 表中元素 ⑤和③、①和⑤均可以组成原子比例为 1 : 1 的物质,这两种物质内所含有的相同的化学键是 ___ 键 ( 填写 “ 离子键 ” 、 “ 极性共价键 ” 或 “ 非极性共价键 ”) (3) 表中元素 ②③④氢化物的稳定性由大到小的顺序为: ___ ( 填写化学式,下同 ) 。 (4) 表中有一种元素的氧化物可作光导纤维材料,它在元素周期表中的位置是 ___ 。 (5) 用电子式表示表中 ③⑥两元素形成化合物的过程 ___ 。 |
|||||||||||||||||||||||||||||||||
| 45. | 详细信息 |
|
I 、 ①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤氧气溶于水 ⑥氯化铵受热分解。 未发生化学键破坏的是 ___________ ;仅发生离子键破坏的是 ___________ ;仅发生共价键破坏的是 ___________ ;既发生离子键又发生共价键破坏的是 ___________ ; II 、下列 8 种化学符号: (1) 表示核素的符号共 ___________ 种。 (2) 互为同位素的是 ___________ 。 (3) 质量相同的 H 2 16 O 和 D 2 16 O 所含中子数之比为 ___________ 。 根据周期表对角线规则,金属 Be 与 Al 单质及其化合物性质相似。试回答下列问题: (4) 写出 Be 与 NaOH 溶液反应生成 Na 2 BeO 2 的离子方程式: ___________ 。 (5)Be(OH) 2 与 Mg(OH) 2 可用 ___________ 试剂鉴别。 |
|
| 46. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下表是元素周期表的一部分,针对表中的 ①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1) 在 ③~⑦元素中,原子半径最大的是 ___________ ; (2) 元素的最高价氧化物对应的水化物中酸性最强的是 ___________ ,碱性最强的是 ___________ ,呈两性的氢氧化物是 ___________ ; (3) 按要求用电子式表示物质的形成过程: ③的氯化物 ___________ ; ⑨的最高价氧化物对应的水化物 ___________ 。 (4) 在 ⑦与⑩的单质中,化学性质较活泼的是 ___________ ,可用什么化学反应说明该事实 ( 写出反应的化学方程式 ) : ___________ 。 |
|||||||||||||||||||||||||||||||||||||
| 47. | 详细信息 |
|
A 、 B 、 C 、 D 、 E 、 F 、 G 、 L 、 I 九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中 B 、 C 、 D 位于同一周期, A 与 E 、 B 与 G 、 D 与 L 分别位于同一主族, C 、 D 、 F 三种元素的原子序数之和为 28 , F 的质子数比 D 多 5 , D 的最外层电子数是 F 最外层电子数的 2 倍, C 和 D 的最外层电子数之和为 11. 请回答下列问题: (1) 元素 B 在周期表中的位置 ___________ ,,以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是 ( 填化学式 ) ___________ , D 、 E 、 F 、 L 所形成的简单离子的半径由大到小的顺序为 ( 用离子符号表示 ) ___________ 。 (2)L 、 I 两元素可按原子个数比 1 : 1 组成化合物 X ,化合物 X 中各原子均满足 8 电子的稳定结构,则 X 的结构式为 ___________ 。 (3)CI 3 常温下呈液态,可与水反应生成一种酸和一种碱,反应方程式为 ___________ 。 (4) 固体化合物 E 2 D 2 投入到化合物 E 2 L 的水溶液中,只观察到有沉淀产生,写出该反应的化学方程式 ___________ 。 |
|
| 48. | 详细信息 |
|
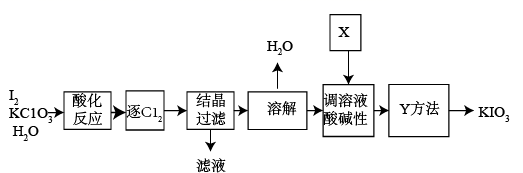
KIO 3 是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题: (1)KIO 3 的化学名称是 _______ 。 (2) 利用 “KClO 3 氧化法 ” 制备 KIO 3 工艺流程如下图所示: “ 酸化反应 ” 所得产物有 KH(IO 3 ) 2 、 Cl 2 和 KCl 。 “ 逐 Cl 2 ” 采用的方法是 _______ 。 “ 滤液 ” 中的溶质主要是 _______ 。 “ 调溶液酸碱性 ” 中发生反应的化学方程式为 _______ 。 (3) 上述流程中 X 的电子式: _______ ,属于 _______ 化合物 ( 填 “ 共价 ” 或 “ 离子 ”) 。 (4) 从溶液中获取 KIO 3 固体的方法为: _______ 。 |
|