2019四川高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
将下列溶液加热蒸干灼烧,最后所得的固体为原溶质的是 ( ) A. NaClO B. KMnO4 C. FeSO4 D. Na2CO3
|
|
| 2. | 详细信息 |
|
下列叙述中与盐类的水解有关的是 ( ) A. 自来水杀菌、消毒 B. 盛放Na2CO3溶液的试剂瓶应用橡皮塞 C. 铁在潮湿的环境下生锈 D. 酸雨在空气中放置一段时间后,pH降低
|
|
| 3. | 详细信息 |
|
下列方程式书写正确的是 ( ) A. HCO3−的电离方程式:HCO3-+H2O B. 泡沫灭火器的原理:Al3++3HCO3- C. AgCl电离方程式:AgCl(s) D. Na2S显碱性原因:S2-+2H2O
|
|
| 4. | 详细信息 |
|
下列事实中不能证明CH3COOH是弱电解质的是 ( ) ①常温下某CH3COONa溶液的pH=8 ②用CH3COOH溶液做导电实验,灯泡很暗 ③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 ④0.1 mol·L-1的CH3COOH溶液的pH=2.1 ⑤pH=1的CH3COOH溶液稀释100倍,pH<3 A. ② B. ②③ C. ①③④⑤ D. ③④⑤
|
|
| 5. | 详细信息 |
|
常温下,25 mL 0.1 mol·L-1的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,下列说法错误的是 ( ) A. 溶液的pH大小顺序是③>①>② B. 分别向其中逐滴滴入相同浓度的盐酸至中性,消耗盐酸最少的是② C. 分别稀释相同倍数后,pH变化最小的是① D. 分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
|
|
| 6. | 详细信息 |
|
下列关于电解质溶液的叙述中正确的是 ( ) A. pH=0的H2SO4溶液与1 mol·L-1 的Ba(OH)2溶液中水的电离程度相同 B. 0.2mol·L-1 CH3COOH溶液中的c(H+)是0.1mol·L-1 CH3COOH中的c(H+)的2倍 C. 室温时,pH=2的CH3COOH和0.01mol·L-1 NaOH溶液等体积混合,混合后pH=7 D. 等物质的量浓度的Na2S和NaHS的混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)]
|
|
| 7. | 详细信息 |
|
某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1-xCoO2+LixC6═LiCoO2+C6(x<1),下列关于该电池的说法错误的是 ( ) A. 放电时,Li+在电解质中由负极向正极迁移 B. 放电时,负极的电极反应式为LixC6 - xe- ═ xLi++C6 C. 充电时,若转移1mol e-,石墨(C6)电极将增重7x g D. 充电时,阳极的电极反应式为LiCoO2 - xe- ═ Li1-xCoO2 + xLi+
|
|
| 8. | 详细信息 |
|
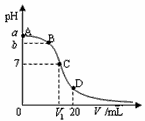
25℃,在20 mL 0.1 mol·L-1氨水溶液中逐滴加入0.1 mol·L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是 ( )
A. 当V=10mL时,溶液中存在: c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-) B. A、C间任一点,溶液可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+) C. 在C点,V1<10mL,且有 c(NH4+)=c(Cl-)=c(OH-)=c(H+) D. 在D点,存在:c(NH4+)+c(NH3·H2O)>c(Cl-)
|
|
| 9. | 详细信息 |
|
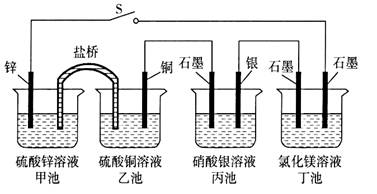
某化学学习小组学习电化学后,设计了下面的实验装置图,则下列有关该装置图的说法中正确的是 ( )
A. 合上电键后,盐桥中的阳离子向甲池移动 B. 合上电键后,丙池为电镀银的电镀池 C. 合上电键后一段时间,丙池中溶液的pH增大 D. 当丁池中生成标准状况下1120 mL Cl2气体时,丁池中理论上最多产生2.9 g固体
|
|
| 10. | 详细信息 |
|
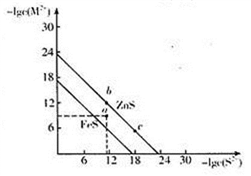
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示。下列说法正确的是
A. 溶解度S(FeS)<S(ZnS) B. a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) C. 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 D. 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大
|
|
| 11. | 详细信息 |
|
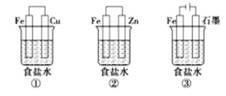
按要求完成下列各小题。 (1)等浓度的三种溶液①NH4HCO3、② NH4Cl、③NH4HSO4,则c(NH4+)由大到小排列的顺序为____(填序号)。 (2)常温下,将0.1 mol·L-1的HCN溶液和0.1 mol·L-1的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH____7,c(HCN)+c(CN-)_____0.1 mol·L-1,c(HCN)-c(CN-)_____2c(OH-)(填“>”,“<”或“=”)。 (3)小苏打溶液显碱性而不是显酸性的原因:________,溶液中离子浓度大小顺序:___________。 (4)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________装置(填装置序号)原理进行防护;装置③中总反应的离子方程式为____________________。检验石墨电极产物气体的方法:_________________________。
|
|
| 12. | 详细信息 | ||||||||
|
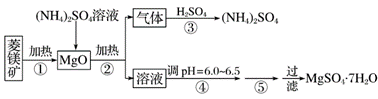
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
(1)步骤②中发生反应的离子方程式为__________________________________________。 (2)步骤④中调节pH=6.0~6.5的目的是_______________________________________。 (3)步骤⑤的操作为________________________________________________________。 (4)若要除去MgSO4溶液中的FeSO4应先加________,再加入过量__________,过滤即可把杂质除尽;请用离子方程式以及文字说明除杂原理___________________________________ (5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________(已知25 ℃时 ,Ksp[Mg(OH)2]=5.6×10-12 )。
|
|||||||||
| 13. | 详细信息 |
|
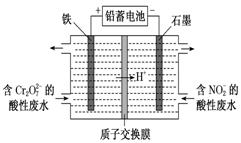
(1)用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水[最终Cr2O72-转化为Cr3+,NO2-转化为无毒物质],其装置如图所示。
①阴极电极反应:________________________, 左池中Cr2O72-转化为Cr3+的离子方程式是_________________________________________。 ②当阴极区消耗2 mol NO2-时,右池减少的H+的物质的量为________ mol。 ③若将铁电极换成石墨棒,阳极电极反应式为:_________________________________。 (2)由甲醇(CH3OH)、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。 ①该电池负极的电极反应式为___________________________________________,正极电极反应式_____________________________________________。 ②若以该电池为电源,用石墨作电极电解200 mL含有2mol·L-1HCl与0.5mol·L-1CuSO4的混合溶液。当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的质量为_____g,总共转移_____mol电子。
|
|
| 14. | 详细信息 |
|
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。某草酸亚铁样品(不含结晶水)中含有少量草酸,现用滴定法测定该样品中FeC2O4的含量。实验方案如下: ①将0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol·L-1的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用高锰酸钾溶液滴定至终点。 ②向滴定终点混合液中加入适量的Zn粉和过量的2 mol·L-1的H2SO4溶液,煮沸5~8 min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.020 00 mol·L-1的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 mL。 试回答下列问题: (2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为______________________________________________________。 (3)滴定过程中眼睛应注视__________________ ,滴定终点现象是 ___________________ (4)在步骤②中,下列操作会引起测定结果偏高的是_____________。 a 滴定管在盛装高锰酸钾前未润洗 b 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 c 滴定前读数正确,滴定终点时俯视读数 d 滴定前尖嘴有气泡,滴定后气泡消失 (5)0.20 g样品中FeC2O4的质量分数为____。(保留3位有效数字,不考虑步骤②中的损耗)
|
|