第5节 物质的溶解 知识点题库
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)欲配制溶质质量分数为5%的稀盐酸溶液200g,需要溶质质量分数为37%的浓盐酸多少毫升?(计算结果保留小数点后一位)
(2)化学综合实践活动小组的同学,对一造纸厂排放的污水进行检测,发现其主要的污染物为氢氧化钠.为了测定污水中氢氧化钠的含量,他们量取80g污水于烧杯中,逐滴加入溶质质量分数为5%的稀盐酸至73g时恰好完全反应(污水中的其他成分不与盐酸反应).求污水中氢氧化钠的质量分数.

下列说法正确的是( )
A . 饱和(NH4)2SO4溶液能区分食盐水和蛋白质溶液
B . 洗洁精和汽油都能清洗油污,其原理相同
C . 饱和溶液转化为不饱和溶液,溶质的质量分数一定减小
D . 98.0%的浓硫酸与等体积水混合,得到49.0%的硫酸溶液
如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是( )

A . 降温
B . 升温
C . 加糖
D . 搅拌
实验室常用98%的浓硫酸,密度为1.84克/厘米3 , 现要配制20%的稀硫酸1000毫升,需要查阅的数据是 ,如果配制过程中不用托盘天平,必须要用到的仪器是烧杯和 .
某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数改变,下列操作可行的是( )
A . 加入硝酸钾晶体
B . 恒温蒸发溶剂
C . 增大压强
D . 降低温度
如图所示,烧杯中盛有一定量的水,试管中盛有一定量的硝酸钾饱和溶液(并有少量固体存在),在饱和溶液中悬浮着一只塑料小球,现向水中加入少量的NaOH固体,则试管中的小球会( )
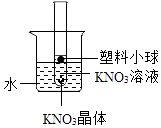
A . 上浮
B . 下降
C . 位置不变
D . 无法确定
下列物质中,随着温度的升高,在水中的溶解度减小的是( )
A . 氢氧化钠
B . 食盐
C . 硝酸钾
D . 氮气
甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图。下列说法正确的是( )

A . t1℃时,三种物质的溶解度:乙>甲>丙
B . 20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是80g
C . 分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D . 分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
碳酸饮料(汽水类产品是指在一定条件下充入二氧化碳气体的饮料,当一瓶喝剩下的汽水瓶壁上还附有许多气泡振荡一下,一些气泡就会离开瓶壁,上浮,最后露出水面消失。下列说法中有科学道理的是( )
A . 打开瓶盖时,有大量气泡冒出是由于温度升高气体溶解度减少引起的
B . 振荡前该饮料是二氧化碳的不饱和溶液
C . 瓶壁上气泡一定受到浮力作用,且气泡受到的浮力等于气泡受到的重力,所以没有上浮
D . 气泡在上升过程中,气泡逐渐变大,所受浮力也逐渐变大
如图所示为A、B两种固体物质的溶解度曲线.

-
(1) 30度时,A的溶解度 (填“大于”、“小于”.或“等于”)B的溶解度;
-
(2) 20度时,若配制溶质质量分数为5%的A溶液100g,需要Ag,配制时要用到的仪器有托盘天平(附砝码)、100ml量筒、滴管、烧杯和
小柯想探索物质A、B的溶解能力,取了某温度下的A、B为溶质的两溶液,溶质质量分数均为20%的 溶液200g,现通过增发溶剂的方法进行比较,一段时间后,用特殊仪器测得A溶液的质量分数变为
25%(无晶体析出),B溶液的质量分数亦为25%(有晶体析出),回答:
-
(1) 蒸发前B溶液中的溶质质量为多少?
-
(2) A溶液质量分数变为25%时蒸发掉的水的质量为多少?
-
(3) 试比较该温度下两物质溶解度,并说明理由?
为研究A物质溶液的性质,可进行以下步骤的实验:
①称量容器为ag,②将一定量A的溶液倒入容器,称量为bg,③将容器放入恒温箱内,在温度为t℃时进行恒温蒸发,④当观察到溶液刚开始微量结晶时,迅速取出容器,冷却后称量为cg,⑤继续加热蒸发并用余热蒸干,称量为dg。
试求:
-
(1) 容器内溶质A的质量为 g ,
-
(2) 原溶液中溶质A的质量分数,
-
(3) 溶液刚开始微量结晶时,剩余溶液的质量约为g,
-
(4) 温度为t℃时,溶质A的溶解度约为 。
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。下图是电解水装置示意图。

-
(1) 实验时会发现两个电极上都有气体产生,这一过程可用文字表达式来表示:。
-
(2) 检验气体时发现与A试管中产生的气体能使带火星的木条复燃,该气体是。
-
(3) 在水中加入少量硫酸或氢氧化钠的目的。
-
(4) 100克5%氢氧化钠溶液用于电解水,一段时间后,水已经电解20克,此时这杯氢氧化钠溶液的质量分数是。
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )

A . t1℃时,相同质量的甲、丙溶液中溶质质量一定相同
B . 若甲物质中含有少量乙,可用降温结晶的方法提纯甲
C . 将100g甲的饱和溶液从t2℃降温到t1℃,可析岀10g甲物质
D . 将甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为乙>甲=丙
如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图回答下列问题:

-
(1) t1℃时,溶解度最大的物质是。
-
(2) 若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是(填序号)。
①降低温度 ②增加溶质 ③蒸发溶剂
实验室配制50g溶质质量分数为5%的氯化钠(NaCl)溶液。
-
(1) 配制的操作示意图如下,其中仪器a的名称是。该实 验的正确操作顺序为(填字母)。

-
(2) 在称取氯化钠固体时,发现天平的指针偏右,接下来的操作应该是。
-
(3) 经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。
①氯化钠固体不纯;②称量时,砝码端忘记垫质量相同的纸片;
③量取水时,仰视读数;④装瓶时,有少量溶液洒出。
一木块漂浮于50 ℃时的硝酸钾饱和溶液中(见甲图),温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积(V排)随时间(t)发生了如图乙所示的变化。由此推测出温度的改变方式是(填“升温”或“降温”),同时观察到烧杯底部硝酸钾晶体(填“增多”或“减少”)。

下列实验过程与图像描述相符合的一组是( )
A .  向一定温度下某饱和氯化钠溶液中加入氯化钾固体
B .
向一定温度下某饱和氯化钠溶液中加入氯化钾固体
B .  向等质量的镁、锌中加入稀硫酸
C .
向等质量的镁、锌中加入稀硫酸
C .  向稀盐酸中加入氢氧化钠溶液
D .
向稀盐酸中加入氢氧化钠溶液
D .  向盐酸和氯化铁的混合溶液中加入氢氧化钠溶液
向盐酸和氯化铁的混合溶液中加入氢氧化钠溶液
 向一定温度下某饱和氯化钠溶液中加入氯化钾固体
B .
向一定温度下某饱和氯化钠溶液中加入氯化钾固体
B .  向等质量的镁、锌中加入稀硫酸
C .
向等质量的镁、锌中加入稀硫酸
C .  向稀盐酸中加入氢氧化钠溶液
D .
向稀盐酸中加入氢氧化钠溶液
D .  向盐酸和氯化铁的混合溶液中加入氢氧化钠溶液
向盐酸和氯化铁的混合溶液中加入氢氧化钠溶液
如图甲所示,一个体积为V1小木块漂浮在90℃温度下一定量的饱和硝酸钾溶液中,此时小木块排开液体的体积为V0。将装置放置在室温20℃的房间里,若此过程中木块始终处于漂浮状态。请根据下图小木块排开液体的体积随时间变化的图像,并进行分析说明。(温馨提示:1.溶液的密度和溶液的浓度有关,硝酸钾溶液的密度随浓度的增大而增大;2.硝酸钾的溶解度随温度的升高而增大;3.溶液体积变化忽略不计)

在一定温度下,若将某不饱和溶液蒸发15 g 水(部分)后,会析出2 g晶体(不含结晶水);若向原溶液投入5 g溶质晶体后,溶液中会剩下1 g固体溶质,则此温度下该溶质的溶解度为( )
A . 13.3 g
B . 26.7 g
C . 33.3 g
D . 40 g
最近更新



