第5节 物质的溶解 知识点题库
①蒸发掉20克水②蒸发掉24克水③加入3.2克氯化钠④加入5克氯化钠.
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
下列说法正确的是( )
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①表中两种物质的溶解度相等的温度范围是在℃.
②20℃时,硝酸钾的溶解度是31.6g/100g水,其含义是.该温度下,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是 g.要进一步提高该溶液的溶质质量分数,可进行的操作是.
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是.
④60℃时,对100g硝酸钾饱和溶液(如A烧杯)进行如下操作,请回答相关问题:
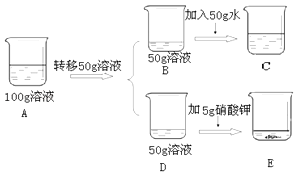
上述溶液中所含溶质的质量DE(填“>”或“<”或“=”,下同),溶液不饱和的是(用A,B,C,D,E填空),溶液B,C,E中溶质质量分数的大小关系是.

-
(1) 这瓶浓盐酸溶液的质量为多少 g?
-
(2) 若用这瓶浓盐酸来配制 200g 溶质质量分数为 10%的稀盐酸,需量取浓盐酸的体积是多少 mL?水的体积是多少 mL?

| 选项 | 操作 | 目的 |
| A | 用剩的食盐放回原试剂瓶 | 避免浪费 |
| B | 用50ml量筒替代天平量取所需的水 | 操作更加简便 |
| C | 溶解时用玻璃棒搅拌 | 增加食盐的溶解能力 |
| D | 天平调平后在左、右托盘中各垫一张纸 | 保证称取的食盐质量更准确 |



| X | Y | Z | |
| A | 溶质 | 溶剂 | 溶液 |
| B | 悬浊液 | 乳浊液 | 溶液 |
| C | 压力 | 重力 | 浮力 |
| D | 饱和溶液 | 不饱和溶液 | 浓溶液 |
-
(1) 第一步:挑选鸭蛋。将鸭蛋放入一定溶质质量分数的食盐溶液,通过观察鸭蛋的浮沉情况进行挑选。现有四种食盐溶液供选择,其溶质质量分数与密度关系如表一。鸭蛋的新鲜情况与其密度变化如图一。分析图一和表一信息,应选用表一中溶质质量分数为的食盐溶液才能挑选出新鲜鸭蛋。
表一 食盐溶液溶质质量分数与密度对照表

溶质质量分数
溶液密度(g/cm3)
2%
1.01
6%
1.03
10%
1.07
15%
1.10
-
(2) 第二步:配制溶液。使用溶质质量分数过大的食盐溶液,鸭蛋的水分流失快、味咸且口感不鲜;使用溶质质量分数过小的食盐溶液,防腐能力较差、营养价值会降低。人们常选用质量分数为10%~20%的食盐溶液。现配制2000毫升质量分数为15%食盐溶液,需要食盐多少克。
-
(3) 第三步:浸泡腌制。将鸭蛋放入容器再倒入15%食盐溶液将其浸没,加盖保存,如图二所示。图二中鸭蛋A的体积为70厘米3 ,计算鸭蛋A所受的浮力大小。
20 克
B . 一定温度下,100 g 的食盐饱和溶液中加入 3 g 食盐,搅拌后可得到 103 g 食盐溶液 C . 一定温度下,向饱和食盐水中加入白糖,白糖不会溶解 D . 浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液向原溶液投入 5 克溶质晶体后,溶液中还剩下 1 克固体溶质,则此温度下该溶质的溶解度为( )
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
溶解度/g |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
|
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
|
-
(1) 由表可查知,40℃时氯化钾(KCl)的溶解度为 40 克,它的意义是。
-
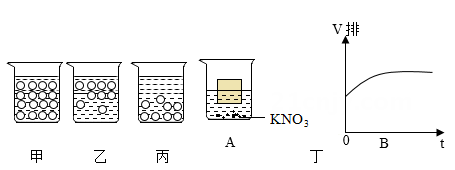
(2) 将少量硝酸钾溶解在水中,长时间放置后,硝酸钾微粒在水中的分布状况如图 所示。(填“甲”、“乙”或“丙”)(图中小圆圈代表硝酸钾微粒)
-
(3) 将一木块漂浮于50℃时的硝酸钾(KNO3)的饱和溶液中,如图丁A所示。当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积V排随时间t发生了如图丁B所示的变化。由此推测出温度的改变是(填“升温”或“降温”)。

-
(1) 需要食盐千克;
-
(2) 你认为农民伯伯该挑选(选填“浮在液面上”或“沉入盐水中”) 的用作 种子;
-
(3) 取上述配制好的质量分数为 16%的食盐溶液 45 千克, 配制成质量分数变为 9%的食盐 水,则需加多少千克水?



