课题 3 利用化学方程式的简单计算 知识点题库
-
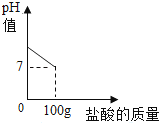
(1) 100g稀盐酸中氯化氢的质量 .
-
(2) 纯碱样品中,纯碱的质量.
-
(3) 恰好完全反应时,所得溶液中溶质的质量分数?
-
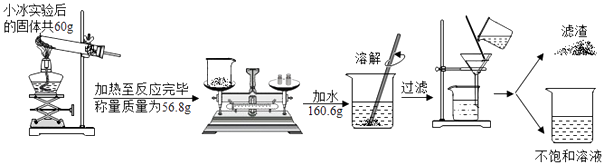
(1) 加热高锰酸钾反应的化学方程式为;
-
(2) 小城的实验生成氧气的质量为;
-
(3) 列出求解小城实验中分解的高锰酸钾质量(x)的比例式;
-
(4) 小冰和小城加热制得氧气的质量比为;
-
(5) 最后所得不饱和滤液中溶质的质量分数为.
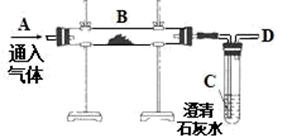
【实验原理】测定C装置中生成的BaCO3沉淀的质量,通过计算确定牙膏中CaCO3的质量分数.
【查阅资料】CO2+Ba(OH)2=BaCO3↓+H2O,牙膏中其他成分遇到盐酸时无气体产生.
【实验装置】

根据探究过程回答下列问题:
-
(1) 装置B中发生反应的化学方程式;
-
(2) 实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;②;
-
(3) 从C中过滤出BaCO3沉淀所需的玻璃仪器有烧杯、和玻璃棒;
-
(4) 实验中准确称取三份牙膏样品,每份4.0g,进行三次测定,测得生成BaCO3的平均质量为1.97g.则样品中CaCO3的质量分数为;
-
(5) 若没有A装置,直接通入空气,则测得CaCO3的质量分数(填“偏大”、“偏小”或“不变”).

-
(1) 写出图中标号仪器的名称:a、b.
-
(2) 实验室可加热KMnO4固体制取O2:
①请写出该反应的化学方程式
②如A所示,加热一段时间后,某同学发现试管口未放置棉花团,应采取的正确操作:,再组装好仪器继续实验.
-
(3) 实验室可用锌粒与稀硫酸反应制取H2 , 请写出该反应的化学方程式:,应选用的装置是(填字母).
-
(4) 实验室选用C装置制取CO2的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑
请计算:
①CO2的相对分子质量是;
②现需收集4 瓶(每瓶0.125L) CO2气体(实验条件下CO2的密度为2g•L﹣1),其质量是 g;
③收集上述CO2至少需要大理石(含CaCO38O%)的质量是 g (精确到0.1g).
-
(1) 原混合物中硫酸镁的质量分数;
-
(2) 所加氢氧化钠溶液中溶质的质量分数。
【实验1】取该混合液50 g ,向其中逐滴加入稀盐酸,当加入稀盐酸的质量为20 g、40 g、60 g 时,生成气体的质量见下表(气体的溶解度忽略不计)。
【实验2】另取该溶液50 g ,加入一定量稀盐酸充分反应后,测得溶液的pH=7,然后再加入硝酸银溶液,测得实验数据见右图。

试分析计算:
-
(1) 【实验1】中,第二组数据 m 为g。
-
(2) 混合液中碳酸钠的质量分数是多少?
-
(3) 混合液中氯化钠的质量分数是多少?(计算结果精确至0.1%)
(提出猜想)猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.碳酸钠和碳酸氢钠。
(查阅资料)①碳酸钠溶液、碳酸氢钠溶液均呈碱性;
②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解。
-
(1) (实验探究1)小亮、小刚分别对有关猜想设计方案并进行实验
实验操作
实验现象
实验结论
小亮
小亮将白色粉末溶于水后用pH试纸测定其酸碱度
pH(填“>”“<”或“=”)7
溶液呈碱性,猜想1成立
小刚
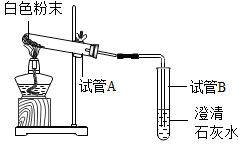
用如图所示的装置进行实验
试管A中有水珠产生,试管B中液体变。
猜想2成立,试管B中反应的化学方程式为。
-
(2) (实验质疑)
小红认为小亮的实验结论错误,理由是(用文字叙述)。
-
(3) 小明认为小刚的实验并不能得出猜想2成立,理由是(用文字叙述)。
-
(4) (实验探究2)为了进一步确定白色粉末的化学成分,小戚称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为mg,通过计算并分析实验数据确定猜想3成立,则m的取值范围为(计算结果用分数表示)
-
(5) (结论分析)探究后他们查到该白色粉末的成分为碳酸氢钠,那么你认为白色粉末中的碳酸钠是如何产生的?写出产生碳酸钠的化学方程式。
-
(1) 样品中氢氧化钾的质量;
-
(2) 稀硫酸中溶质的质量分数。
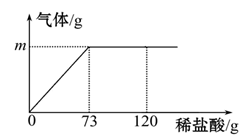
当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应。
-
(1) m的值为。
-
(2) 计算反应后溶液的质量是多少?
-
(3) 当加入120克稀盐酸时,溶液中溶质有。
-
(1) 这些氧气在标准状况下的体积是L?(标准状况下氧气密度为1.43g/L,计算结果保留一位小数)
-
(2) 若在实验室以高锰酸钾为原料制取相同质量的氧气,需要多少kg的高锰酸钾?。
-
(3) 用(2)中的方法给登山运动员供氧,是否可行?简述理由。。
-
(1) 探究燃烧条件:B盛木炭粉。
①由A处通N2一段时间后,加热B,B、C无明显变化。
②待B冷却至室温,由A处通入O2一段时间,B、C无明显变化。
③由A处继续通入O2 , 加热B,木炭粉燃烧,C中溶液变浑浊。
结论:由①、③可知燃烧需要;由②、③可知燃烧需要。
-
(2) 探究CO与金属氧化物反应:
探究铁的氧化物的组成:A处通CO,B盛铁的氧化物(FexOy),B处下方放酒精喷灯、D处放酒精灯。
①实验前,先要进行的步骤是(填a或b)a.加热b.通一氧化碳;
②已知B处铁的氧化物(FexOy)质量为8.7g,实验完成后C中得15g白色沉淀,则这种铁的氧化物的化学式为。
-
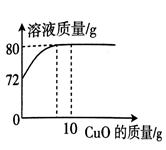
(1) 完全反应时共消耗氧化铜的质量为g;
-
(2) 求反应后所得溶液中溶质的质量分数;。
-
(3) 将反应后的溶液稀释成质量分数为10%的溶液,需加水g。
-
(1) 黄铜属于(填“是”或“不是金属材料。)
-
(2) 则黄铜中铜的质量分数是多少?(写出计算过程)
-
(1) 写出化学方程式:
①实验室用氯酸钾和二氧化锰制取氧气。
②实验室用大理石和稀盐酸制取二氧化碳。
-
(2) 这三种常见化石燃料的燃烧都会产生二氧化碳。大气中二氧化碳的含量不断上升,导致温室效应增强,全球气候变暖。
-
(3) 中国科学院大连化学物理研究所研发的“液态阳光”技术可助力中国完成碳达峰、碳中和目标。“液态阳光”技术的第一步是光能的转化,目前可采用光伏发电的形式:第二步是电解水制取氢气;第三步是二氧化碳和氢气反应制取甲醇。
①该技术的第一步实现了将能转化为能。
②该技术的第二步对应的化学方程式为。
③二氧化碳和氢气反应制取甲醇的化学方程式为
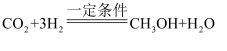 。请计算:若生产2t甲醇,消耗二氧化碳的质量是多少? (利用化学方程式进行计算,写出计算过程)
。请计算:若生产2t甲醇,消耗二氧化碳的质量是多少? (利用化学方程式进行计算,写出计算过程)
-
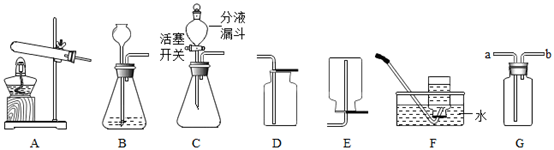
(1) A中的试管口为什么略向下倾斜?。
-
(2) 用B装置制取氧气时,长颈漏斗下端浸没在液面以下的原因是什么?。
-
(3) 实验室用高锰酸钾制取一瓶纯净的氧气应选用的一套装置为(填字母代号,从装置A~F中选);其反应的化学方程式为;实验结束时,要先把导管移出水面,再熄灭酒精灯,请解释原因。
-
(4) 氧气可采用D装置收集并用带火星的木条检验,这是利用了氧气的哪些性质?。
-
(5) 若用G装置采用排水法收集O2请简述操作步骤。
-
(6) 实验室有不纯的氯酸钾样品,把12.5g该样品和1g二氧化锰的固体混合物加热制取氧气(杂质不参加反应),待反应完全后,称量剩余固体物质为8.7g。请计算氯酸钾在样品中的质量分数。
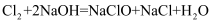 。某同学将Cl2通入185.8 g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:
。某同学将Cl2通入185.8 g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:
-
(1) 参加反应的氯气质量是g。
-
(2) 混合溶液中次氯酸钠的质量分数。(写出完整的计算过程)
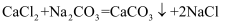 )实验数据如下表:
)实验数据如下表:实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入CaCl2溶液的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
反应后溶液的总质量/g | 118.0 | 136.0 | M | 172.0 | 192.0 |
请根据实验数据分析解答下列问题:
-
(1) 表中数据M的值为。
-
(2) 第次恰好完全反应。
-
(3) 该样品中碳酸钠的质量分数是多少?



