课题 3 利用化学方程式的简单计算 知识点题库
小兵在实验室利用氯酸钾与二氧化锰的混合物27g制氧气,加热至不再有气体放出为止,测得剩余固体质量为17.4g.为了节约药品,小兵将剩余的固体加水搅拌,当加入35.1g水时,发现剩余固体质量不在减少,过滤后得到氯化钾溶液和二氧化锰固体.试求:
①生成氧气的质量.
②所得氯化钾溶液的溶质质量分数.
现有9.4gCaCO3和K2CO3的固体混合物,测得其中含有氧元素的质量为3.6g,将该混合物与100g稀盐酸混合,恰好完全反应.则最后所得不饱和溶液的质量为( )
A . 105g
B . 106.1g
C . 107.6g
D . 108.3g
实验室制备二氧化碳的实验如下:
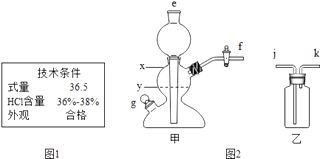
-
(1) 市售浓盐酸的标签局部见图1,该盐酸中HCl质量分数的范围是.为使制备过程中二氧化碳平稳地产生且较纯净,应将该浓盐酸.
-
(2) 用甲装置制备二氧化碳,选择的固体药品是(选填编号).
a.粉末状石灰石 b.块状大理石 c.粉末状熟石灰 D.块状生石灰
-
(3) 控制所加盐酸的量,使反应时甲装置内液面位于处(选填“x”或“y”)为宜.
-
(4) 收集二氧化碳,应将甲的处于乙的处连接(选填有关编号).
-
(5) 写出用澄清石灰水检验二氧化碳的化学方程式.
-
(6) 反应生成了0.1mol二氧化碳,求稀盐酸中参与反应的HCl的质量.(根据化学方程式列式计算).
食盐不仅是人类不可替代的食用调味品,而且是一种重要的化工原料,被称为“化学工业之母”,比如可以用来制盐酸,下面是其工艺流程:
①把固体食盐溶解在水中形成饱和粗盐水,除去钙镁离子、天然有机物及难溶物等杂质,将精制后的合格盐水送入电解槽,通直流电进行电解,产生氯气、氢气和烧碱(NaOH)
2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
②将氢气、氯气处理合格后,送至合成炉内进行燃烧合成反应H2+Cl2  2HCl
2HCl
③生成的氯化氢气体在吸收器内溶于水得到盐酸
某化工厂日生产氯气146t,计算每天可以制得氯化氢气体的质量是多少?(结果保留2位小数)
某纯碱样品中含有少量氯化钠.现称取该样品12g,完全溶于60g水中,加入63.4g稀盐酸,恰好完全反应,最后称得烧杯中溶液的质量为131g.计算:
-
(1) 完全反应后生成CO2的质量;
-
(2) 反应后所得溶液的溶质质量分数.
酸碱盐是初中化学重要的化合物
-
(1) 将①浓盐酸②浓硫酸③NaOH溶液④Ca(OH)2溶液⑤NaCl溶液分别敞口放置在空气中,一段时间后,溶液质量增加的是.(填序号)
-
(2) 欲将50g溶质质量分数为98%的浓硫酸稀释成溶质质量分数为19.6%的稀硫酸,需要加水g,请简述稀释浓硫酸的正确操作.
-
(3) 用NaOH固体配置50g质量分数为10%的NaOH溶液来制作“叶脉书签”,所需的玻璃仪器有,量取水时若仰视读数,会使制得的溶液中溶质的质量分数(填“偏大”、“偏小”或“不变”)
-
(4) 向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,a点时溶液中的溶质是,c点时向溶液中加入紫色石蕊溶液呈色.
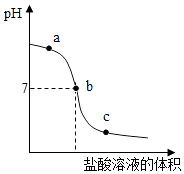
-
(5) 使用纯碱中常含有少量的氯化钠,现取某使用纯碱样品2.5g,加水溶解,配成溶液,向其中加入一定量CaCl2溶液恰好完全反应,同时产生了2g沉淀.试计算该食用纯碱中Na2CO3的质量分数(写出计算过程).
石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
剩余固体的质量 | 3g | 2g | 1g | 1g |
-
(1) 该石灰石样品中碳酸钙的质量分数是;
-
(2) 计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%).
将10.6g碳酸钠与50g稀盐酸放入同一烧杯中混合,二者恰好完全反应。
试计算:
-
(1) 生成二氧化碳多少克,
-
(2) 反应后,所得溶液中溶质的质量分数。(写出计算过程)
将一定质量的CO和CO2的混合气体通入足量的澄清石灰水中,充分反应后,生成沉淀的质量恰好等于原混合气体的质量,则原混合气体中CO和CO2的质量比为( )
A . 7:11
B . 11:14
C . 14:11
D . 11:7
现有一包碳酸钙和生石灰的混合物,为测定其中碳酸钙的含量,取样品21.2g将其放入足量的稀盐酸中,充分反应后,将溶液蒸干,得白色固体33.3g,则样品中碳酸钙的含量约为()
A . 52.8%
B . 47.2%
C . 36%
D . 64%
某同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/5向其中加入CaCl2溶液。反应时CaCl2溶液与沉淀的质量关系如图所示。
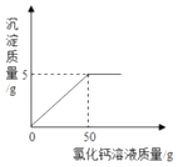
-
(1) 样品中氢氧化钠的质量为g;
-
(2) 计算所加CaCl2溶液中溶质的质量分数。(写出计算过程)
烧杯内有氢氧化钠粉末,小明想进行探究,看氢氧化钠是否变质和变质多少,称量后加水溶解,又加入足量的澄清的石灰水,反应后过滤、干燥,得到沉淀的质量是原粉末质量的一半。
-
(1) 写出生成沉淀的化学方程式。
-
(2) 这份氢氧化钠的纯度是。
溶洞的水中溶有碳酸氢钙,化学式为Ca(HCO3)2。当遇热或压强突然变小时,碳酸氢钙会分解生成CaCO3 , 从而沉积下来,同时生成CO2和H2O。
-
(1) 碳酸氢钙中钙、氢元素的质量比为。
-
(2) 若沉积10 g CaCO3 , 需要Ca(HCO3)2的质量是多少?
实验是学习和研究化学的重要途径。
-
(1) 装置甲的实验用到了足量红磷,其反应的化学方程式为;反应结束后,待装置冷却至室温后,打开弹簧夹,图甲中试管容积为40mL,注射器活塞从10mL刻度处缓慢移动至mL刻度处停止(误差忽略不计)。
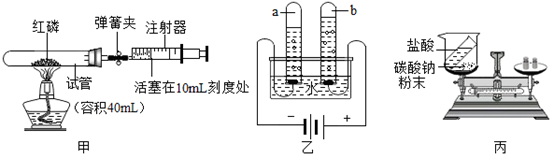
-
(2) 装置乙可进行电解水的实验。此实验可以得出水是由组成的;在使用a试管内气体前,从实验安全的角度考虑,应该首先进行的操作是;b试管内气体的化学性质是(写出一条即可)。
-
(3) 利用装置丙,我们可以探究化学反应前后物质的质量关系。
①该装置不能验证质量守恒定律,请说明理由。
②用微粒的观点解释质量守恒定律。
-
(4) 实验室常用加热高锰酸钾的方法制取氧气,若产生3.2g氧气,则需要高锰酸钾的质量是多少?
工业上用电解饱和NaCl溶液的方法制烧碱,其反应的化学方程式如下:
2NaCl + 2H2O  2NaOH + H2↑+Cl2↑
2NaOH + H2↑+Cl2↑
-
(1) H2O的相对分子质量为,H2O中氢、氧元素的质量比为。
-
(2) NaOH中氧元素的质量分数计算式为。
-
(3) 计算117kg NaCl完全反应产生氢气的质量为。
以下是实验室制取气体时常用的部分仪器,回答下列问题。

-
(1) 在实验室用大理石和稀盐酸制取二氧化碳,并采用向上排空气法收集:
①仪器 A 的名称是;
②组装制取装置时,需选择上图中的 A、C、G、H、M 和;
-
(2) 要制取 8.8g 二氧化碳气体,需要浓度为 7.3%的稀盐酸g。
为了测定混有少量氯化钠的碳酸氢钠(NaHCO3)固体的质量分数。现进行如下实验:向盛有9.6g该样品的烧杯中加入94.8g盐酸,恰好完全反应。反应过程用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
|
反应时间 |
T0 |
T1 |
T2 |
T3 |
T4 |
T5 |
|
烧杯和药品的质量/g |
210 |
207.8 |
206.6 |
205.9 |
205.6 |
205.6 |
-
(1) 完全反应后生成气体的质量是g;
-
(2) 样品中NaHCO3的质量分数是;
-
(3) 反应后溶液中溶质质量分数是多少? (写出计算过程, 结果保留一位小数)
下列四个图像不能正确反映其对应变化关系的是( )
A . 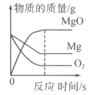 等质量的镁条和等质量的氧气反应
B .
等质量的镁条和等质量的氧气反应
B .  向等质量的铁粉和锌粉中分别加入足量的浓度相同的稀盐酸
C .
向等质量的铁粉和锌粉中分别加入足量的浓度相同的稀盐酸
C . 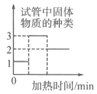 实验室加热高锰酸钾制取氧气,试管中固体物质的种类变化
D .
实验室加热高锰酸钾制取氧气,试管中固体物质的种类变化
D .  向等质量的氧化锌和氢氧化锌中分别加入相同浓度的稀盐酸至过量
向等质量的氧化锌和氢氧化锌中分别加入相同浓度的稀盐酸至过量
 等质量的镁条和等质量的氧气反应
B .
等质量的镁条和等质量的氧气反应
B .  向等质量的铁粉和锌粉中分别加入足量的浓度相同的稀盐酸
C .
向等质量的铁粉和锌粉中分别加入足量的浓度相同的稀盐酸
C .  实验室加热高锰酸钾制取氧气,试管中固体物质的种类变化
D .
实验室加热高锰酸钾制取氧气,试管中固体物质的种类变化
D .  向等质量的氧化锌和氢氧化锌中分别加入相同浓度的稀盐酸至过量
向等质量的氧化锌和氢氧化锌中分别加入相同浓度的稀盐酸至过量
某化学兴趣小组为测定生铁样品中铁的质量分数,他们的实验过程和有关数据如图所示(生铁样品中的杂质不与稀硫酸反应)。请计算:
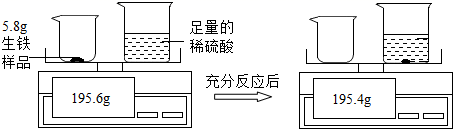
-
(1) 实验中生成气体的质量为g。
-
(2) 生铁样品中铁的质量分数为。(结果保留到0.1%)
实验室用34g过氧化氢溶液和适量的二氧化锰混合制取氧气,生成氧气的质量与反应时间的关系如图所示。
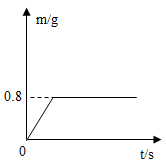
-
(1) 反应生成氧气的质量为g。
-
(2) 实验所用的过氧化氢溶液的浓度为。
最近更新



