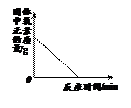课题 3 利用化学方程式的简单计算 知识点题库
有等质量的镁和铁,前者放入质量分数为10%的稀硫酸中,后者放入质量分数为10%的稀盐酸中,产生氢气的质量随时间变化曲线如图所示。下列说法错误的是()
工业上常用二氧化碳和氨气(化学式:NH3)反应来制取尿素[化学式:CO(NH2)2],该反应的化学方程式为:CO2+2NH3 CO(NH2)2+H2O,现生产240t尿素,需要氨气的质量为多少?
CO(NH2)2+H2O,现生产240t尿素,需要氨气的质量为多少?
工业上用电解NaCl溶液的方法来制取NaOH、Cl2和H2 , 反应的化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.现取一定质量分数的NaCl溶液87.3g进行电解,当NaCl完全反应时,生成0.2gH2 .
2NaOH+H2↑+Cl2↑.现取一定质量分数的NaCl溶液87.3g进行电解,当NaCl完全反应时,生成0.2gH2 .
-
(1) 当NaCl完全反应时,生成Cl2的质量为 g,参加反应的NaCl的质量为 g.
-
(2) 当NaCl完全反应时,所得NaOH溶液中溶质的质量分数为多少?(假设生成的Cl2和H2全部逸出)(要有计算过程)
-
(1) 生产氢气 g.
-
(2) 稀硫酸中H2SO4的质量是 g.
-
(3) 合金中铜的质量分数是多少?
物质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量/g | 0 | 12 | 15 | 待测 |
已知x的相对分子质量为n,Q的相对分子质量为2n,则下列推断正确的是( )

-
(1) 看图1回答,铁元素的原子序数为,相对原子质量为.亚铁离子(Fe2+)的核外电子数为,质子数为.
-
(2) 健康人体内,总量4~5g的铁元素主要以化合物形式存在,缺铁会患上(填字母).
a.骨质疏松 b.甲状腺疾病 c.贫血症 d.侏儒症
-
(3) 【实验一】兴趣小组通过图2实验研究铁的冶炼
该装置的设计有一明显不当之处,你的改进方案是.
-
(4) 试写出一氧化碳和氧化铁在高温下生成铁的化学反应方程式;
-
(5) 实验一段时间后,观察到B处澄清石灰水变;A处红棕色固体变为黑色,小明将所得的黑色固体物质放入足量的稀硫酸中,发现有少量气泡.写出反应的化学方程式,说明黑色固体物质(填字母).
a.不含铁 b.一定全部是铁 c.含有铁
-
(6) 【资料1】已知铁的氧化物均能逐步失去其中的氧,最终被还原为铁.
Fe2O3
 Fe3O4
Fe3O4  FeO
FeO  Fe
Fe【资料2】实验研究表明:该实验得到是四氧化三铁与铁粉的混合物
【实验二】研究后兴趣小组用图3实验研究实验一所得黑色粉末中单质铁的质量分数
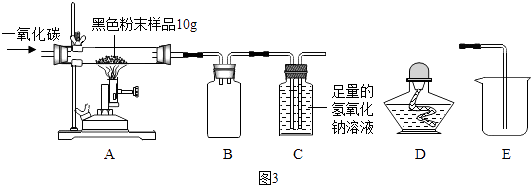
【资料3】氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,但吸收能力比石灰水强
从安全与规范的角度考虑,装置C后面应连接(选填装置序号)
-
(7) 铁与四氧化三铁的混合物10g充分反应后,玻璃管中剩余固体(单质铁)的质量为7.6g.请计算10g黑色粉末中单质铁的质量分数.
实验序号 | X的用量/g | Y的用量/g | 生成X2Y的质量/g |
1 | 7.4 | 1.6 | 8.0 |
2 | 9.6 | 3.2 | 12.0 |
参加反应的X与Y的质量比为( )
A | B | C | D |
|
|
|
|
向一定量铁粉中滴加稀盐酸液 | 用酒精灯加热一定量KMnO4固体 | 向一定量澄清石灰水中加入Na2CO3溶液 | 向盛有MnO2的烧杯中加入H2O2溶液 |
-
(1) Cu2(OH)2CO3中质量分数最大的元素是。
-
(2) 若用100g 98%的浓硫酸充分吸收反应所产生的水,得到硫酸溶液的溶质质量分数是多少? (计算结果精确到0.1%)
-
(3) 样品中碱式碳酸铜的质量分数是多少?
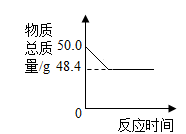
-
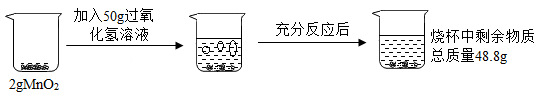
(1) 反应中二氧化锰的作用是。
-
(2) 反应生成氧气的质量为g。
-
(3) 计算参加反应的过氧化氢的质量。(写出必要的计算过程)
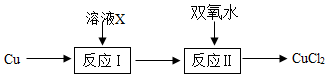
已知:①反应I CuCl2+Cu+2HCl=2HCuCl2
②反应Ⅱ2HCuCl2+H2O2=2CuCl2+2H2O
-
(1) 两次生成O2的总质量为g;
-
(2) 理论上可回收到MnO2的质量(写出计算过程).
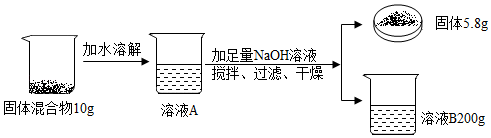
-
(1) MgCl2中镁元素和氯元素的质量比为。
-
(2) 计算溶液B中NaCl的质量分数(写出计算过程)。
试计算:
-
(1) 生成氧气的质量为g。
-
(2) 该瓶过氧化氢溶液的溶质质量分数。
-
(1) 元素在自然界分布并不均匀,按它们的质量分数计算,地壳中含量最多的金属元素是(填元素名称)。
-
(2) 钢铁是应用最普遍的金属材料,某些铁制零件防锈措施是涂油,其防锈原理为。盐酸常用于金属表面除锈,请写出用盐酸去除铁锈的化学方程式。
-
(3) 日常使用的金属材料,大多数属于合金。下列说法正确的是(填字母)。
a 合金的熔点一般比其组分高
b 合金的硬度一般比其组分大
c 合金的抗腐蚀性一般比其组分强
-
(4) 向硝酸银和硝酸镁的混合溶液中加入一定量的铁粉,观察到溶液由无色变为浅绿色,对混合溶液进行过滤,则滤液中一定含有的溶质是。
-
(5) 铁矿石炼铁的原理是:在高温下,利用炉内反应生成的一氧化碳把铁从铁从铁矿石中还原出来。冶炼2000t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石的质量是多少?(请利用化学方程式进行计算,在答题纸写出完整的计算过程,计算结果保留整数)

-
(1) CaCO3中钙元素的质量分数为。
-
(2) 若按照补钙药品说明书服食钙片,与胃酸充分反应后(人体胃酸的主要成分是盐酸,钙片中除CaCO3外其他成分都不与盐酸反应),理论上每日生成二氧化碳的质量是多少?
 。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
-
(1) 电瓶在放电时,能转化为电能。
-
(2) 假如某个电瓶中铅的质量为1800g,请计算:当有621g铅参加反应时,理论上需消耗硫酸的质量(要求写出计算过程)。
-
(1) 反应生成沉淀的质量;
-
(2) 反应后所得溶液中溶质的质量分数。