课题 3 利用化学方程式的简单计算 知识点题库
-
(1) 判断此时两种溶液是否完全反应,并说明理由.
-
(2) 待测溶液的溶质质量分数.
-
(1) 原混合物中硫酸钠的质量分数;
-
(2) 反应后所得溶液中溶质的质量分数.
 Cu+H2O).某兴趣小组同学在一份资料中了解到:铜有CuO和Cu2O(红色)两种常见的氧化物,Cu和Cu2O均为红色,故他们猜测,在H2还原CuO所得的红色产物中可能含有Cu2O.
Cu+H2O).某兴趣小组同学在一份资料中了解到:铜有CuO和Cu2O(红色)两种常见的氧化物,Cu和Cu2O均为红色,故他们猜测,在H2还原CuO所得的红色产物中可能含有Cu2O.
-
(1) 该小组同学准确称取了8.0g黑色CuO粉末放入大试管中,不断通入足量的H2 , 在加热条件下进行还原,如果产物只有Cu,其质量应为.
-
(2) 该小组在H2还原CuO时,当发现8.0g黑色CuO粉末全部转变成红色时,停止加热,冷却后称得固体质量为6.8g.此红色固体中氧元素的质量为,以此推得Cu2O的质量为.
-
(3) 将(2)中所得的6.8g固体放入烧杯中,加入48.0g过量稀盐酸(Cu2O与稀盐酸的反应为:Cu2O+2HCl═CuCl2+Cu+H2O ),充分搅拌,除有红色固体外,还发现溶液变成蓝绿.试计算此蓝色溶液中CuCl2的质量分数(精确到0.01% ).
-
(1) 该生铁样品中铁的质量.
-
(2) 反应后所得溶液中溶质的质量分数.
-
(1) 【提出问题1】鸡蛋白中主要的营养成分是 ;
-
(2) 【查阅资料】
a、CaCO3灼烧分解生成氧化钙和一种无毒的氧化物。
b、蛋壳中的其它成分不参加反应。
c、NaHCO3+HCl= NaCl + H2O +CO2↑,Ba(OH)2+CO2=BaCO3↓+H2O,
d、已知仪器a装有10%的稀盐酸,其他成分均不与HCl反应,装置内试剂均足量。
【提出问题2】蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0g蛋壳设计了以下不同的实验方案:
小华的方案:
称取12.0g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:减少的质量是(填化学式)的质量,经计算得蛋壳中的CaCO3的质量分数为 。
-
(3) 小明的方案:小明设计了如下图所示的实验装置。
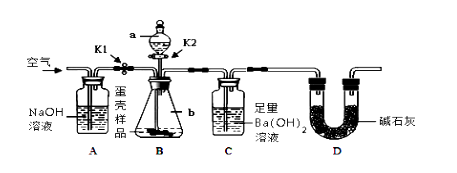
【实验步骤】
①按上图连接好装置后,并 ;
②向B装置中加入蛋壳样品后,先通入空气一会儿;
③接下来的实验操作是 ,直到 为止(填实验现象);
④再通入空气一会儿,至装置C中不再产生沉淀为止;
⑤将装置C中的固液混合物过滤、洗涤、烘干后称量其质量;
⑥重复上述实验。
【实验数据】重复实验,3次数据记录如下:
实验次数
实验1
实验2
实验3
装置C中沉淀质量(g)
19.68
19.75
19.67
-
(4) 【实验分析及数据处理】
①上述数据能否用托盘天平称量 。(填“能”或“不能”)
②若无A装置,直接通入空气,则测定结果将 。(填“偏大”、“偏小”或“不变”)D装置的作用是
③实验重复3次的目的是 。
④请利用3次实验数据的平均值,计算该蛋壳中的CaCO3质量分数 。
【实验反思】
下列各项措施中,能提高小明测定准确度的是 (填序号)。
Ⅰ.在装置A、B之间增加盛有浓硫酸的洗气瓶
Ⅱ.缓缓滴加稀盐酸
Ⅲ.在装置B,C之间增加盛有饱和NaHCO3的洗气瓶
IV.直接称量装置C反应前后的质量

-
(1) 上述燃料的使用都能产生(填化学式),导致温室效应增强。如果?处是氢气,请说出氢气目前还不能作为燃料被广泛应用的一条原因。
-
(2) 丙烷燃烧的微观示意图如下所示:
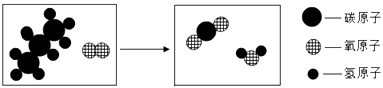
该反应前后不变的粒子是(填化学符号);反应的的化学方程式为。
-
(3) 已知在相同的温度和压强下,相同体积的气体具有相同的分子数。20L管道煤气(假设只含CO、H2、CH4)充分燃烧消耗O2的体积可能是 。A . 10L B . 15L C . 40L D . 50L

-
(1) 请根据图中数据计算高锰酸钾的质量为多少?(写出计算过程)
-
(2) 请在图2坐标中,画出固体中锰元素质量在t0﹣t5时段变化示意图.
(反应的化学方程式:2KMnO4
 K2MnO4+MnO2+O2↑)
K2MnO4+MnO2+O2↑)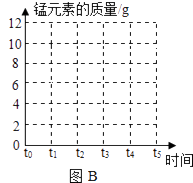
-
(1) 充分反应后,生成氧气的质量为g;
-
(2) 参加反应的过氧化氢溶液中溶质的质量分数为.
求:
-
(1) 该石灰石中CaCO3的质量分数多少?
-
(2) 这些二氧化碳用多少木炭充分燃烧可制得?
-
(1) 此反应中二氧化锰起作用。
-
(2) 制得氧气的质量是。
-
(3) 原固体中氯酸钾的质量是多少克?(写出计算过程)
解:
-
(1) 生成氧气的质量。
-
(2) 剩余固体中氧元素的质量。
-
(1) 碳酸钙中钙元素的质量分数为多少?
-
(2) 该石灰石中碳酸钙的质量分数为多少?(小数点后保留一位数字)
|
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
|
|
加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
|
加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
|
充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
试求:
-
(1) 表中X的值为;
-
(2) 样品中碳酸钙的质量分数;
-
(3) 烧杯④中物质充分反应后所得溶液的质量。
-
(1) 制取的氧气是多少克?
-
(2) 原混合物中氯酸钾的质量是多少?
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
-
(1) 理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量(写出计算过程)。
-
(2) 实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值(填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是。
反应前
反应后
NaHCO3/g
锥形瓶+稀硫酸/g
锥形瓶+反应后溶液/g
1.26
24.59
25.36
-
(1) 充分反应后,生成氧气的质量为g;
-
(2) 求参加反应的过氧化氢的质量。
-
(1) 杀菌原理
波尔多液的有效成分为碱式硫酸铜(Cu2(OH)2SO4),会与植物在新陈代谢过程中分泌出的酸性液体反应,缓慢释放铜离子,起到杀菌作用,铜离子的符号为。
-
(2) 配制方法
将生石灰、硫酸铜按比例分别溶于水。将容器1、2中的液体倒入容器3,搅拌均匀。配制波尔多液应在碱性条件下进行,否则配制出的药液会随即沉淀、失效,配制时,应向容器3中(填编号)。
Ⅰ.先倒入石灰水,后倒入硫酸铜溶液 Ⅱ.先倒入硫酸铜溶液,后倒入石灰水
-
(3) 配制要求
①应使用新制生石灰配制石灰乳,原因是。
②容器2和3不宜选择铁制容器,用化学方程式解释原因。
-
(4) 安全提示
①进行容器1内的操作前,应佩戴防护面具和手套,原因是。
②波尔多液对人体有害,若不慎误食,去医院就诊前,可以先服用大量富含蛋白质的食物缓解,以下物质中符合条件的是(填字母)。
A.豆浆 B.牛奶 C.橙汁 D.鸡蛋清
-
(5) 学农实践
某兴趣小组配制波尔多液用于预防校园内种植的葡萄感染霜霉病。已知:
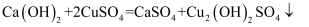 。预估使用量后,兴趣小组称取16g硫酸铜,计算理论上获得的碱式硫酸铜的质量是多少?
。预估使用量后,兴趣小组称取16g硫酸铜,计算理论上获得的碱式硫酸铜的质量是多少?



