第二章 化学物质及其变化 知识点题库
-
(1) Ⅰ.将NaHSO4溶液滴入到Ba(OH)2溶液中至中性的离子方程式:
-
(2) 将5-6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体。写出反应的离子方程式:
-
(3) 在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是(用离子方程式表示)。
-
(4) 向Na2S2O3 中加入稀硫酸反应的离子方程式。
-
(5) Ⅱ.金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物
Cr2O

Cr(OH)3
Cr3+
CrO2-
CrO

颜色
橙色
灰蓝色
蓝紫色
绿色
黄色
含铬元素的化合物可以发生如图一系列变化:
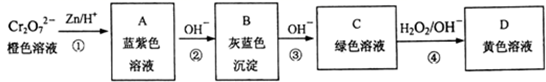
①写出反应④的离子方程式:。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为。
-
(6) Ⅲ.二氧化硫是常见大气污染气体,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应Na2SO3+CaO+H2O=CaSO3↓+2NaOH
若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的离子方程式
 Pb+SO2。
Pb+SO2。
-
(1) 请将上述反应用单线桥法标出电子转移的方向和数目:
-
(2) 上述反应的氧化剂是 ,还原剂是,氧化产物是,还原产物是。
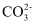 +2H+=CO2↑+H2O
B . 硫酸溶液与氢氧化钡溶液的反应: H++OH-=H2O
C . 硝酸银与氯化钠溶液的反应:AgNO3 +Cl-=AgCl↓+NO3-
D . 铝与硫酸铜溶液的反应:2Al+3Cu2+=2Al3++3Cu
+2H+=CO2↑+H2O
B . 硫酸溶液与氢氧化钡溶液的反应: H++OH-=H2O
C . 硝酸银与氯化钠溶液的反应:AgNO3 +Cl-=AgCl↓+NO3-
D . 铝与硫酸铜溶液的反应:2Al+3Cu2+=2Al3++3Cu
 B . ZnCl2=Zn2++
B . ZnCl2=Zn2++ 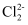 C . BaSO4=Ba2++
C . BaSO4=Ba2++  D . Na3PO4=
D . Na3PO4= 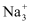 +
+ 
 ,下列说法正确的是( )
,下列说法正确的是( )
 B .
B .  C .
C .  D .
D . 
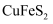 , 还含有少量
, 还含有少量 )制备
)制备 的工艺流程如下:
的工艺流程如下: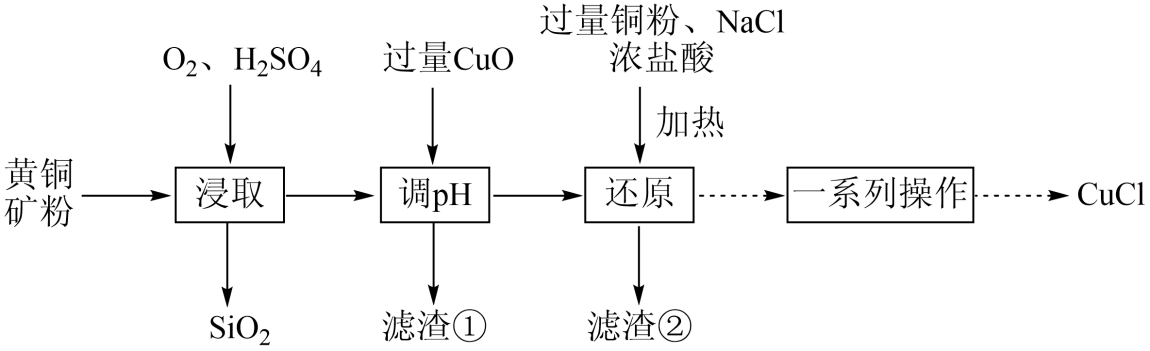
回答下列问题:
-
(1) 已知:
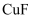 的熔点为
的熔点为 , 熔化呈液态时能导电。
, 熔化呈液态时能导电。 的熔点为
的熔点为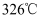 , 能升华,熔化呈液态时不导电。则
, 能升华,熔化呈液态时不导电。则 晶体属于(填晶体类型)。
晶体属于(填晶体类型)。
-
(2) “浸取时,硫元素转化为硫酸根离子,则反应的离子方程式为。
-
(3) “滤渣①”的成分是
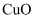 、(填化学式)。
、(填化学式)。
-
(4) 已知在水溶液中存在平衡:
 (无色)。“还原”操作中,当出现现象时,表明“还原”进行完全。
(无色)。“还原”操作中,当出现现象时,表明“还原”进行完全。
-
(5) 已知:常温下,
 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子已沉淀完全。若浸取后的溶液中
时,可认为该离子已沉淀完全。若浸取后的溶液中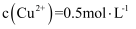 , 加入氧化铜(忽略溶液体积变化),使溶液中
, 加入氧化铜(忽略溶液体积变化),使溶液中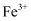 恰好沉淀完全,此时是否有
恰好沉淀完全,此时是否有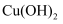 沉淀生成?(填“没有”或“有”)。
沉淀生成?(填“没有”或“有”)。
-
(6)
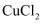 和
和 是铜的两种常见的氯化物。
是铜的两种常见的氯化物。①下图表示的是(填“
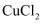 ”或“
”或“ ”)的晶胞。
”)的晶胞。
②原子坐标参数表示晶胞内部各原子的相对位置,图中b位置原子的坐标参数为
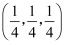 , 则图中d位置原子的坐标参数为。
, 则图中d位置原子的坐标参数为。
-
(1) 化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①CaSO4中阴离子的空间构型为。
②写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:。
③充分沉淀后测得废水中F-的含量为19.0mg·L-1 , 此时SO
 的浓度为mol·L-1。[已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9]
的浓度为mol·L-1。[已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9] -
(2) 氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。已知:
ⅰ.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ⅱ.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
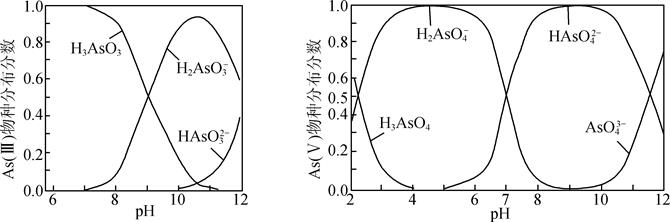
①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:。
②其他条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。方式I:先加NaClO溶液,再加FeSO4溶液;方式II:先加FeSO4溶液,再加NaClO溶液。反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是
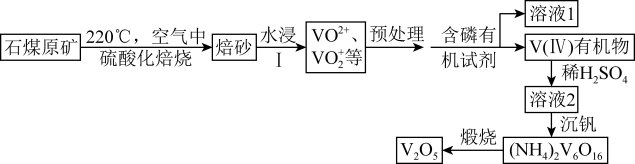
资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO +8H2O
+8H2O H2V10O
H2V10O +14H+
+14H+
ⅴ.氢氧化物完全沉淀时溶液的pH表
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
完全沉淀 | 3.2 | 9.0 | 4.7 |
-
(1) 焙烧过程中向石煤中加硫酸焙烧,将V2O3转化为VOSO4的化学方程式是。
-
(2) 预处理过程中先加入Na2SO3溶液进行还原预处理,加入Na2SO3溶液的第一个作用是将V(V)还原为V(IV)减少钒的损失,再用氨水混合并调节溶液pH。
①请结合相关离子方程式,说明加入Na2SO3的第二个作用。
②解释加氨水调节pH≈5的原因是。
-
(3) 上述I的具体操作为。
-
(4) 沉钒过程中先加入NaClO3进行氧化,再加氨水调节pH,铵盐会将H2V10O
 中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是。
中的钒元素以多钒酸铵((NH4)2V6O16)的形式沉淀。溶液pH值与沉钒率的关系如图,请结合反应原理解释沉钒的pH=2.5的原因是。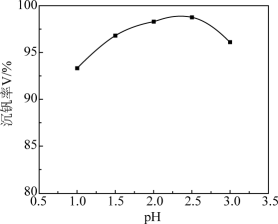
-
(5) 测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO 被还原为Mn2+ , 假设杂质不参与反应。则产品中V2O5的质量分数是。(V2O5的摩尔质量:182g•mol-1)
被还原为Mn2+ , 假设杂质不参与反应。则产品中V2O5的质量分数是。(V2O5的摩尔质量:182g•mol-1)
 )>c(Cl-)>c(OH-)
C . 0.1 mol/LNa2CO3溶液和0.1 mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO
)>c(Cl-)>c(OH-)
C . 0.1 mol/LNa2CO3溶液和0.1 mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO )+3c(HCO
)+3c(HCO )+3c(H2CO3)
D . 0.1 mol/LNa2C2O4溶液和0.1 mol/L盐酸等体积混合(H2C2O4为二元弱酸):2c(C2O
)+3c(H2CO3)
D . 0.1 mol/LNa2C2O4溶液和0.1 mol/L盐酸等体积混合(H2C2O4为二元弱酸):2c(C2O )+c(HC2O
)+c(HC2O )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)



