第二章 化学物质及其变化 知识点题库
 、Ba2+、Cl-、NO
、Ba2+、Cl-、NO  B . Na+、Cl-、 CO
B . Na+、Cl-、 CO  、HCO
、HCO  C . Ca2+、Mg2+、NO
C . Ca2+、Mg2+、NO  、CO
、CO  D . K+、OH-、Cl-、SO
D . K+、OH-、Cl-、SO 
 的溶液中:NH
的溶液中:NH  、K+、SO
、K+、SO  、OH-
B . 无色透明的溶液中:Mg2+、K+、SO
、OH-
B . 无色透明的溶液中:Mg2+、K+、SO  、NO
、NO  C . 含有大量Ba2+的溶液中:Na+、Cu2+、SO
C . 含有大量Ba2+的溶液中:Na+、Cu2+、SO  、Cl-
D . 使石蕊溶液呈红色的溶液中:NH
、Cl-
D . 使石蕊溶液呈红色的溶液中:NH  、K+、CO
、K+、CO  、NO
、NO 
 、Ca2+、Cl-、
、Ca2+、Cl-、  、
、  中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法错误的是( )
中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法错误的是( ) 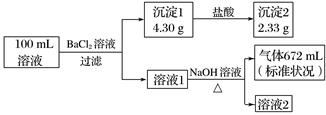
 、
、  和
和  B . 原溶液中一定不存在Ca2+ , 无法判断Cl-是否存在
C . 要确定Cl-是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D . 原溶液中c(K+)≥0.1mol·L-1
B . 原溶液中一定不存在Ca2+ , 无法判断Cl-是否存在
C . 要确定Cl-是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D . 原溶液中c(K+)≥0.1mol·L-1
 、CO
、CO  B . Fe3+、Na+、I–、SCN–
C . K+、Fe3+、NO
B . Fe3+、Na+、I–、SCN–
C . K+、Fe3+、NO  、Cl–
D . NH
、Cl–
D . NH  、Al3+、SO
、Al3+、SO  、OH–
、OH–
 +
+  +H2O,氧化剂与还原剂物质的量比为1:1
C . 1molN2与H2完全反应生成NH3 , 新形成的化学键为2mol
D . 1molSO3溶于水形成1L的溶液,溶质的物质的量浓度为2mol/L
+H2O,氧化剂与还原剂物质的量比为1:1
C . 1molN2与H2完全反应生成NH3 , 新形成的化学键为2mol
D . 1molSO3溶于水形成1L的溶液,溶质的物质的量浓度为2mol/L
-
(1) ①写出氮气的结构式;
②写出医疗用内服药剂“钡餐”主要成分的化学式;
-
(2) 写出醋酸与少量碳酸钠溶液反应的离子方程式。
 N2H5+ 的平衡常数K=9.55x107
N2H5+ 的平衡常数K=9.55x107
| 选项 | 实验操作及现象 | 实验目的 |
| A | 向无色溶液中滴加FeCl3溶液和CCl4 , 振荡、静置,下层显紫红色 | 证明溶液中含有I- |
| B | 向某溶液中先加入少量氯水,然后加入KSCN溶液,溶液变为血红色 | 证明溶液中含有Fe2+ |
| C | 在盛有漂白粉的试管中滴入70%的硫酸,立刻产生黄绿色气体 | 证明硫酸具有还原性 |
| D | 将3 LSO2和1 LO2混合通过灼热的V2O5充分反应,产物先通入BaCl2溶液,有白色沉淀,再通入品红溶液,溶液褪色 | 验证SO2与O2的反应为可逆反应. |
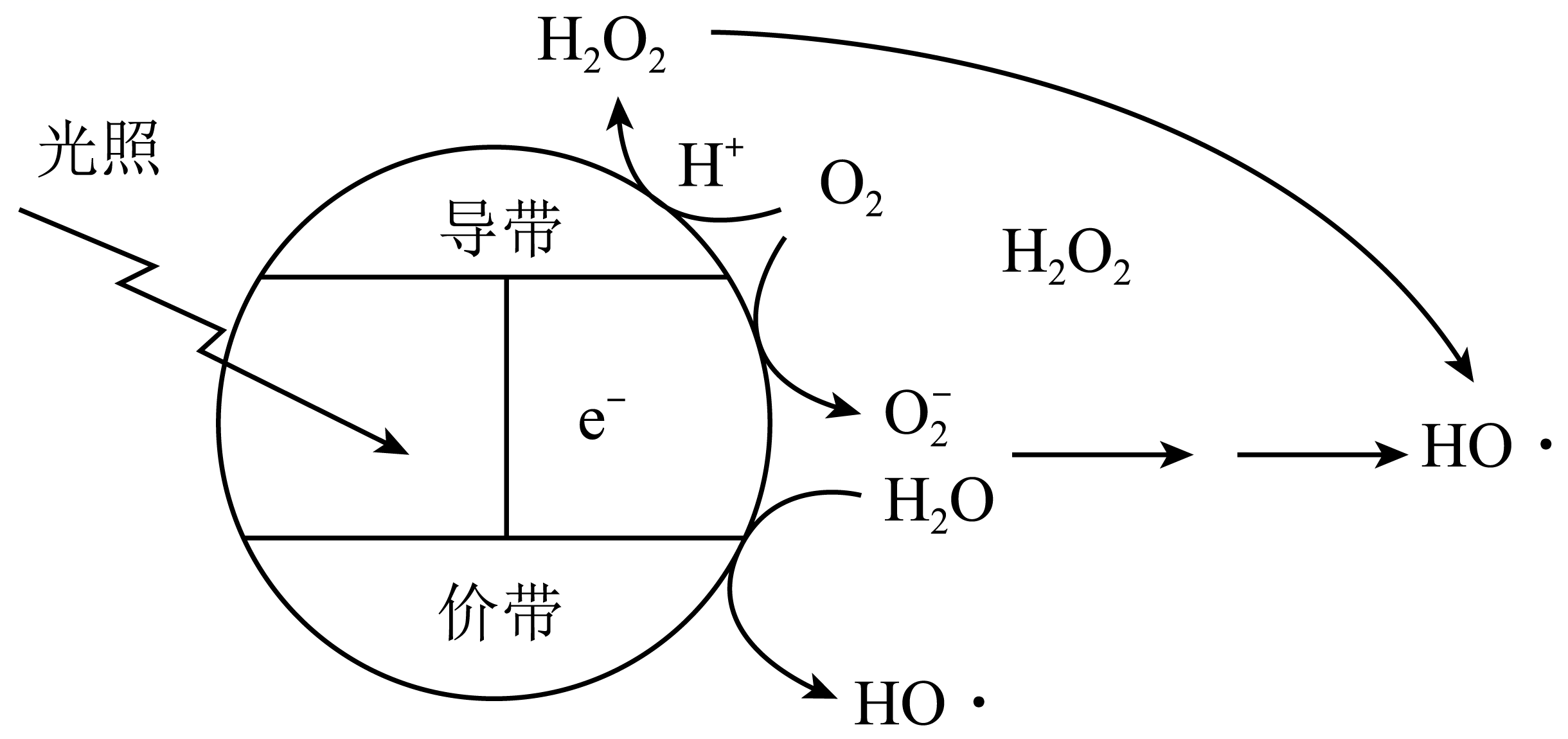
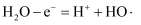 D . 电子从导带流向价带
D . 电子从导带流向价带
-
(1) 工业上,FeCl3溶液作为将铜箔刻制成电路的“腐蚀液”,产物是CuCl2和,回收铜,可向腐蚀后的溶液中加入 ( 选填“钠块”铁粉”或“银粉”)
-
(2) 过氧化钠(Na2O2) 中氧的化合价为, 它可用于呼吸面具中的供氧剂,其反应中氧化剂与还原剂的物质的量之比为。
-
(3) 某化学兴趣小组拟开展探究FeSO4溶液性质的实验。回答下列问题:
①用绿矾(FeSO4· 7H2O)配制500mL 0.1mol/L的FeSO4溶液,需要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需使用(填仪器名称)。
②下列操作可能使所配溶液浓度偏大的是(填选项编号)。
A.未洗涤烧杯和玻璃棒
B.定容时俯视容量瓶的刻度线定容
C.配制溶液前容量瓶中有少量的蒸馏水
D.摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
③FeSO4溶液露置在空气中颜色会加深,如图为该溶液露置在空气中,并在300s时加入10滴维生素C溶液,其色度(即颜色的色调和饱和度)随时间变化的图像,则维生素C导致溶液色度变化的原因是。

选项 | 化合物 | 单质 | 混合物 | 电解质 | 非电解质 |
A | 烧碱 | 液氧 | 冰水混合物 | 醋酸 | 氧化钙 |
B | 干冰 | 生铁 | 氨水 | 石灰石 | 葡萄糖 |
C | 生石灰 | 白磷 | 盐酸 | 氧化铝 | 酒精 |
D | 空气 | 氮气 | 小苏打 | 氯化铜 | 硫酸钡 |
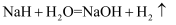 。下列有关该反应的说法正确的是( )
。下列有关该反应的说法正确的是( )
 中氢元素被氧化
C . 该反应属于置换反应
D .
中氢元素被氧化
C . 该反应属于置换反应
D .  既是氧化产物又是还原产物
既是氧化产物又是还原产物
-
(1) I.碳元素作为一种形成化合物种类最多的元素,其单质及化合物具有广泛的用途。
储能材料是当今科学研究的热点,C60(结构如图)可用作储氢材料。继C60后,科学家又合成了Si60、N60 , 下列有关说法正确的是。

a.C60、Si60、N60都属于新型化合物
b.C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d.已知金刚石中C-C键长154pm,C60中C-C键长145-140pm,故C60熔点高于金刚石
-
(2) II.玻璃生产离不开碳酸盐,原料在熔炉里发生的主要反应如下:2Na2CO3+CaCO3+3SiO2
 2Na2SiO3+CaSiO3+3CO2↑
2Na2SiO3+CaSiO3+3CO2↑上述反应中,反应物之一在熔融状态下不导电,该物质属于晶体。写出气体产物的电子式,其属于分子(填“极性”或“非极性”)。
-
(3) 上述反应中,在周期表中相邻的两种元素的原子半径>(填元素符号);处于第三周期的元素名称是;金属性最强的短周期元素原子核外有种不同能级的电子,其单质在O2中燃烧,生成的产物可能有(写化学式)。
-
(4) III.碳元素能形成多种酸,如常见的碳酸、草酸(H2C2O4)等。已知下列3个变化:
 →CO2、
→CO2、 →CO2、Fe3+→Fe2+。
→CO2、Fe3+→Fe2+。找出其中一个变化与“
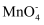 →Mn2+”组成一个反应,写出该反应的离子方程式并配平。
→Mn2+”组成一个反应,写出该反应的离子方程式并配平。 -
(5) 上述反应中的高锰酸钾在不同条件下可发生如下反应:
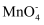 +5e+8H+→Mn2++4H2O;
+5e+8H+→Mn2++4H2O;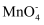 +3e+2H2O→MnO2+4OH-;
+3e+2H2O→MnO2+4OH-;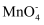 +e→
+e→
①由此可知,高锰酸根离子(
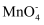 )反应后的产物与有关。
)反应后的产物与有关。②高锰酸钾溶液与硫化亚铁发生如下反应:10FeS+6KMnO4+24H2SO4→3K2SO4+6MnSO4+5Fe2(SO4)3+10S↓+24H2O,已知该反应进行一段时间后,固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为个。
 B . 碳酸钙与盐酸溶液反应:
B . 碳酸钙与盐酸溶液反应: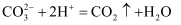 C . 碳酸氢钠溶液和过量盐酸混合
C . 碳酸氢钠溶液和过量盐酸混合 D . 硫酸溶液与氢氧化钡溶液反应:
D . 硫酸溶液与氢氧化钡溶液反应:



