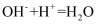第二章 化学物质及其变化 知识点题库
-
(1) 按如图所示操作,充分反应后:
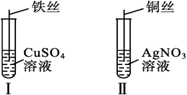
①Ⅰ中发生反应的离子方程式为;
②Ⅱ中铜丝上观察到的现象是;
③结合Ⅰ、Ⅱ的实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为。
-
(2) 将少量Cl2通入FeBr2溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;将足量Cl2通入FeBr2溶液中,反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2。这个事实说明具有还原性的粒子的还原性强弱顺序为。
-
(1) 要确定铁的某氯化物FeClx的化学式。可用离子交换和中和的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸中和,结束时消耗盐酸25.0mL,则x值为
-
(2) 现有一含有FeCl2和FeCl3的混合样品,采用上述方法测得n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为。在实验室中,FeCl2可用铁粉和反应制备,FeCl3可用铁粉和反应制备
-
(3) FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
-
(4) 高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4 , 其反应的离子方程式为。
 =1012的溶液中:Fe2+、Mg2+、NO
=1012的溶液中:Fe2+、Mg2+、NO  、Cl-
B . 澄清透明的溶液中:H+、Cu2+、SO
、Cl-
B . 澄清透明的溶液中:H+、Cu2+、SO  、NO
、NO  C . 0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO
C . 0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO  D . 由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO
D . 由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO 
 溶液中滴加少量浓
溶液中滴加少量浓  ,溶液橙色加深:
,溶液橙色加深: 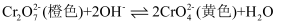 B . 已知电离平衡常数:
B . 已知电离平衡常数: 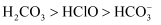 ,向
,向  溶液中通入少量
溶液中通入少量  :
:  C . 硫代硫酸钠与稀硫酸反应:
C . 硫代硫酸钠与稀硫酸反应:  D . 氢氧化铁溶于氢碘酸(强酸):
D . 氢氧化铁溶于氢碘酸(强酸): 

 键数目相等
键数目相等
 3CO2+2Fe。下列说法正确的是 ( )
3CO2+2Fe。下列说法正确的是 ( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向某溶液中滴加几滴KSCN溶液 | 溶液变红 | 溶液中不可能含Fe2+ |
| B | 将铝箔置于火焰上灼烧 | 铝箔胀大并有熔融物滴落 | 铝箔灼烧生成氧化铝 |
| C | 将几滴饱和FeCl3溶液滴入一烧杯的沸水中,继续煮沸至溶液呈红褐色,停止加热 | 用激光笔照射烧杯中的液体,看到一条光亮的“通路” | 生成了Fe(OH)3胶体 |
| D | 向新制氯水中滴加几滴紫色石蕊试液 | 溶液先变红后褪色 | 新制氯水具有酸性和强氧化性 |

-
(1) Ⅰ.NaClO的制备:
该学习小组按如图装置进行实验(部分夹持装置已省去),反应一段时间后,测得C中溶液的
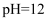 ;已知:饱和NaClO溶液pH为11。
;已知:饱和NaClO溶液pH为11。仪器a的名称为,装置A中发生反应的离子方程式为。
-
(2) C瓶溶液中c(ClO-)+c(Cl-)c(Na+) (填“>”、“<”或“=”)。
-
(3) 装置B的作用为。
-
(4) Ⅱ.测定NaCl的浓度:
取C瓶溶液20.00mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应:
 。用0.1000mol/LNa2S2O3标准溶液滴定该锥形瓶中的溶液,常选用作指示剂,当加入最后一滴Na2S2O3标准溶液时,其现象为,重复操作2~3次,Na2S2O3溶液的平均用量为20.00mL(已知:
。用0.1000mol/LNa2S2O3标准溶液滴定该锥形瓶中的溶液,常选用作指示剂,当加入最后一滴Na2S2O3标准溶液时,其现象为,重复操作2~3次,Na2S2O3溶液的平均用量为20.00mL(已知:  )。计算C瓶溶液中NaClO的物质的量浓度为mol/L。
)。计算C瓶溶液中NaClO的物质的量浓度为mol/L。 -
(5) 若滴定结束时俯视滴定管读数,则测定的NaClO的物质的量浓度将(填“偏高”、“偏低”或“无影响”)。
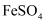 ,可将
,可将  还原为
还原为 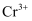 :
: 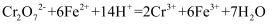 ,再加入熟石灰进行中和,最终将
,再加入熟石灰进行中和,最终将 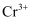 转变为
转变为 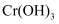 沉淀而从废水中除去。回答下列问题:
沉淀而从废水中除去。回答下列问题:
-
(1) 方程式中氧化剂和还原剂的物质的量之比为。
-
(2) 熟石灰的化学式是,中和时发生反应的离子方程式为。
-
(3)
 和熟石灰反应生成
和熟石灰反应生成 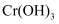 沉淀的离子反应方程式为。
沉淀的离子反应方程式为。
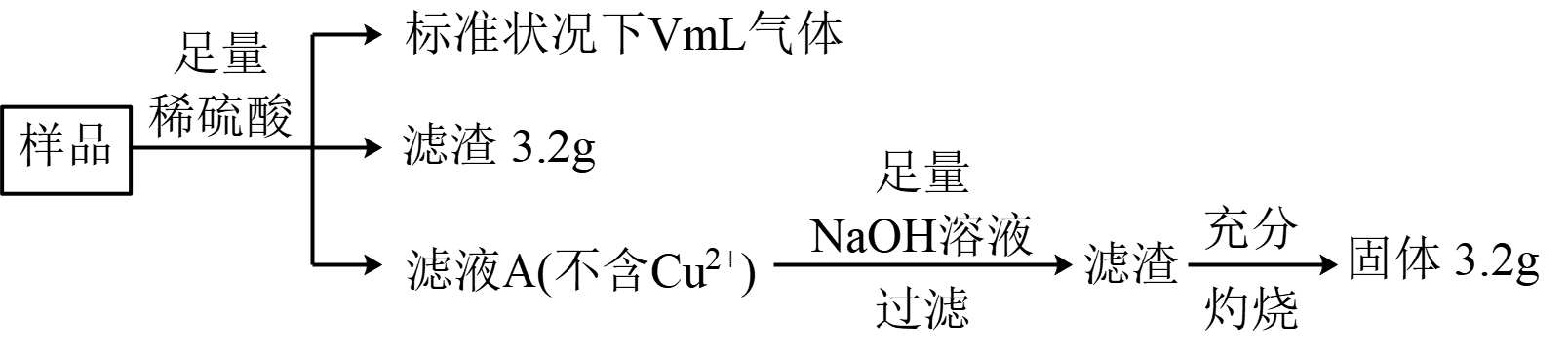
下列说法不正确的是( )
 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如图流程: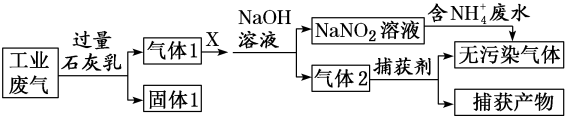
下列说法错误的是( )
 废水时,发生的反应为:
废水时,发生的反应为: +
+ =N2↑+2H2O
=N2↑+2H2O
-
(1) 写出H2O2的结构式:。
Fe3+可用作H2O2分解的催化剂,反应的机理为:
①Fe3++ H2O2=Fe2++H++·OOH
②H2O2+X=Y+Z+W
③Fe2++·OH=Fe3++OH-
④H++OH-=H2O
根据上述机理推导步骤②中的化学方程式为。
-
(2) ①H2O2是一种二元弱酸,它与少量的Ba (OH)2反应的化学方程式为。
②H2O2还能使酸性KMnO4溶液褪色,写出反应的离子方程式。
-
(3) 现一种制备H2O2的一种工艺简单、能耗低的方法,反应原理如图所示,该制备反应的总反应方程式为。
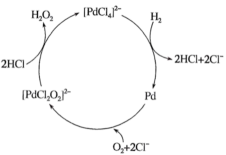
-
(4) 科学家对H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲:
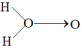 、乙:H−O−O−H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
、乙:H−O−O−H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5) 2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式):。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d, 请设计d的实验方案。
碱性氧化物 | 酸 | 盐 | 混合物 | 电解质 | |
A | CaO | HNO3 | 纯碱 | 漂白粉 | NaCl |
B | NO | NaHSO4 | NaOH | 碱石灰 | 蔗糖 |
C | Na2O2 | Al(OH)3 | NaHCO3 | CuSO4·5H2O | NH3 |
D | SO2 | HClO | 烧碱 | Fe(OH)3胶体 | H2O |
 B . 钠和氯气反应:
B . 钠和氯气反应: C . 铁和盐酸反应:
C . 铁和盐酸反应: D . 氢氧化钡溶液与硫酸反应:
D . 氢氧化钡溶液与硫酸反应: