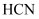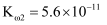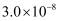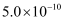第二章 化学物质及其变化 知识点题库
 是阿伏加德罗常数的值,下列说法正确的是( )
是阿伏加德罗常数的值,下列说法正确的是( )
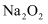 ,转移电子数为2
,转移电子数为2  B .
B .  的NaOH溶液中,含有
的NaOH溶液中,含有  的数日为0.01
的数日为0.01  C . 电子数为
C . 电子数为  的
的  分子的质量为1.6g
D . 标准状况下,3.36 L的
分子的质量为1.6g
D . 标准状况下,3.36 L的  中含有氧原子的数目为0.45
中含有氧原子的数目为0.45 
 PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D . 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D . 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
 中,被氧化和被还原的硫原子个数比为( )
中,被氧化和被还原的硫原子个数比为( )
 B . Mg2+、
B . Mg2+、  、
、  、Cl-
C . K+、Na+、
、Cl-
C . K+、Na+、  、Cl-
D . K+、
、Cl-
D . K+、  、Cl−、S2−
、Cl−、S2−
-
(1) ①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法错误的是(填字母序号)。
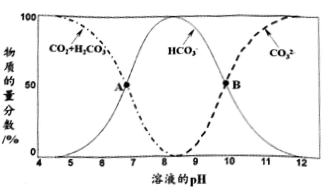
a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是。
-
(2) 海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2 , 该过程的离子方程式是。
-
(3) 洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2 , 是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是。
②上述方式使处理后海水pH升高的原因是。
-
(1) 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是,具有(填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作(填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:。
-
(2) Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:
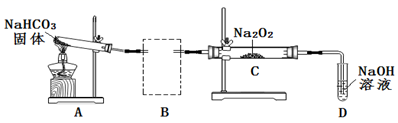
①根据实验目的,虚线框中的装置所用的试剂为。
②装置C中观察到的现象是,反应的化学方程式是。
③装置A的作用是制备CO2 , 写出A中发生反应的化学方程式是。
请回答:
-
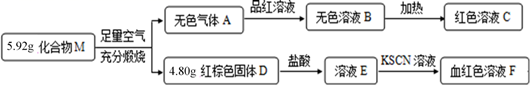
(1) 溶液E的颜色是,溶液E转化为溶液F的离子方程式是。
-
(2) 化合物M的化学式为。
-
(3) 化合物M在足量空气中充分煅烧的化学方程式为。
-
(4) 将气体A通入溶液E中,其反应的离子方程式为。
途径①: 
途径②: 
途径③: 
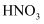 的强氧化性
B . 途径②、③的第二步反应在实际生产中可以通过增大
的强氧化性
B . 途径②、③的第二步反应在实际生产中可以通过增大  的浓度来降低成本
C . 由途径①、②、③分别制取
的浓度来降低成本
C . 由途径①、②、③分别制取 
 ,理论上各消耗
,理论上各消耗  S,各转移
S,各转移 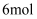
 D . 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理念
D . 途径②、③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理念
|
化学式 |
| | | |
| 电离平衡常数 | | | | |
请回答下列问题:
-
(1)
 、
、  、HClO、HCN的酸性由强到弱的顺序。
、HClO、HCN的酸性由强到弱的顺序。
-
(2) 向NaCN中通入少量的
 ,发生反应的离子方程式为。
,发生反应的离子方程式为。
-
(3) 取
 (冰醋酸)作导电性实验,测得其平衡时的导电率随加入的水量变化如图所示:
(冰醋酸)作导电性实验,测得其平衡时的导电率随加入的水量变化如图所示: 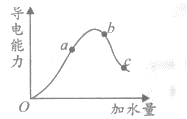
①常温下,若实验测得c点处溶液中
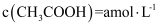 ,
, 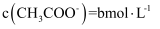 ,则该条件下
,则该条件下  的电离常数
的电离常数  (用含a、b的代数式表示)。若使此溶液中
(用含a、b的代数式表示)。若使此溶液中  的电离程度增大且
的电离程度增大且  也增大的方法是。
也增大的方法是。②从图像可知,在一定浓度的醋酸溶液中加水,
 (填“增大”,“减小”或“不确定”)。
(填“增大”,“减小”或“不确定”)。 -
(4) pH相等,体积相同的两份溶液A(盐酸)和
 分别与不同质量的锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是___________(填写序号)。
A . 反应所需要的时间:
分别与不同质量的锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是___________(填写序号)。
A . 反应所需要的时间: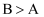 B . 开始反应时的速率:
B . 开始反应时的速率: 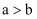 C . 参加反应的锌物质的量:
C . 参加反应的锌物质的量: 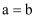 D . A中有锌剩余
D . A中有锌剩余
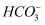 ═CaCO3↓+2H2O+
═CaCO3↓+2H2O+  D . 向Ca(HCO3)2溶液中加入过量的 NaOH溶液:Ca2++2
D . 向Ca(HCO3)2溶液中加入过量的 NaOH溶液:Ca2++2 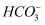 +2OH﹣═CaCO3↓+
+2OH﹣═CaCO3↓+  +2H2O
+2H2O
 、Al3+、Na+、
、Al3+、Na+、  B . I-、
B . I-、  、K+、Cu2+
C .
、K+、Cu2+
C .  、Cl-、
、Cl-、  、K+
D . OH-、
、K+
D . OH-、  、Na+、Cl-
、Na+、Cl-
-
(1) Ⅰ.实验室中可以用以下反应制备氯气:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
该反应的氧化剂是,氧化产物是。
-
(2) 氧化剂与还原剂的物质的量之比是。
-
(3) 消耗0.5molMnO2时,转移电子的物质的量是。
-
(4) Ⅱ.工业上主要采取电解饱和食盐水的方法制取氯气。
电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:
A.Na2CO3溶液 B.Ba(OH)2溶液 C.稀盐酸
其中合理的加入顺序为(填序号,为除杂完全,一般加入试剂会过量,每种试剂只能用一次) -
(5) 在电解饱和食盐水制氯气的同时,还生成了H2和NaOH,发生反应的化学方程式是。
 溶液是一种常见的强氧化剂,
溶液是一种常见的强氧化剂,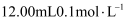 的酸性
的酸性 溶液恰好把
溶液恰好把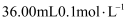 的草酸(H2C2O4)完全氧化,产物中铬元素的化合价为( )
的草酸(H2C2O4)完全氧化,产物中铬元素的化合价为( )
 B .
B .  溶于水:
溶于水: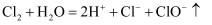 C .
C .  溶于稀盐酸:
溶于稀盐酸: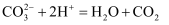 D . 氢氧化钡溶液中加入稀硫酸:
D . 氢氧化钡溶液中加入稀硫酸:
 。下列关于该反应的说法正确的是( )
。下列关于该反应的说法正确的是( )
 既是氧化产物,又是还原产物
D . 每生成2mol Na时转移电子的物质的量为4mol
既是氧化产物,又是还原产物
D . 每生成2mol Na时转移电子的物质的量为4mol