第二章 化学物质及其变化 知识点题库
能正确表示下列反应的离子方程式的是( )
A . 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B . Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C . 磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+=Fe2++2Fe3++4H2O
D . 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
常温下,下列有关离子反应的说法不正确的是( )
A . 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B . 将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
C . NaClO溶液通入少量SO2,反应的离子方程式为:SO2+2ClO-+H2O=SO32-+2HClO
D . c(H+)水=1×10-13 mol·L-1的溶液中,Na+、K+、SO32-、CO32-可能大量存在
下列表述的反应,没有发生电子转移的是( )
A . 氧化钠与水
B . 次氯酸见光分解
C . 过氧化钠与水
D . 过氧化钠与二氧化碳
将硫粉和铁粉均匀混合,放在石棉网上堆成条状,用灼热的玻璃棒触及混合粉末的一端,当混合物呈红热状态时,移开玻璃棒。下列有关叙述错误的是( )

A . 反应生成Fe2S3
B . 该反应为放热反应
C . 该反应中的氧化剂是S
D . 1molS参加该反应转移2mol电子
下列实验一定不能达到目的的是( )
| 选项 | 目的 | 实验 |
| A | 证明醋酸是弱酸 | 向醋酸钠溶液中加入酚酞溶液 |
| B | 检验Na2CO3溶液中是否混有NaCl | 取样,加入过量的硝酸后,再滴加硝酸银溶液 |
| C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓NaOH溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体 |
| D | 制取较高浓度的次氯酸溶液 | 将Cl2通入小苏打溶液中 |
A . A
B . B
C . C
D . D
化学与生产、生活和社会发展密切相关,下列叙述正确的是( )
A . 碳纳米管属于胶体,具有较高强度
B . 淀粉、纤维素、脂肪、蛋白质都是天然高分子化合物
C . 除去锅炉中的水垢时,可先用碳酸钠溶液处理,使水垢蓬松,再加入酸去除
D . 碳酸钡可用于肠胃X射线造影检查
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A . 无色透明的溶液:Na+、Cu2+、  、
、  B .
B .  的溶液:
的溶液:  、Ca2+、Cl-、
、Ca2+、Cl-、  C . c(Fe2+)=1mol·L-1的溶液:K+、
C . c(Fe2+)=1mol·L-1的溶液:K+、  、
、  、
、  D . 水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、
D . 水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、  、
、 
 、
、  B .
B .  的溶液:
的溶液:  、Ca2+、Cl-、
、Ca2+、Cl-、  C . c(Fe2+)=1mol·L-1的溶液:K+、
C . c(Fe2+)=1mol·L-1的溶液:K+、  、
、  、
、  D . 水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、
D . 水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、  、
、 
下列离子方程式错误的是( )
A . 向  溶液中滴加
溶液中滴加  溶液:
溶液:  B . 用
B . 用  溶液制作印刷电路板:
溶液制作印刷电路板: 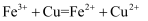 C . 等物质的量的
C . 等物质的量的  和
和  同时通入水中
同时通入水中  D .
D . 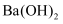 溶液与等体积、等物质的量浓度的
溶液与等体积、等物质的量浓度的  溶液反应:
溶液反应: 
 溶液中滴加
溶液中滴加  溶液:
溶液:  B . 用
B . 用  溶液制作印刷电路板:
溶液制作印刷电路板: 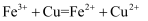 C . 等物质的量的
C . 等物质的量的  和
和  同时通入水中
同时通入水中  D .
D . 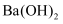 溶液与等体积、等物质的量浓度的
溶液与等体积、等物质的量浓度的  溶液反应:
溶液反应: 
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 16gCH4含有C—H键的数目为4NA
B . 1L1.0mol/L的盐酸含有HCl分子总数为NA
C . 标准状况下,22.4LNO与11.2LO2混合后的分子数目为NA
D . 23gNa与足量O2反应,转移电子数目为1.5NA
市场上出售的“褪字灵”,其本质是利用氧化还原反应,先利用酸性高锰酸钾溶液褪去字迹,再用草酸(H2C2O4)消除高锰酸钾溶液的颜色,下列有关叙述正确的是( )
A . 草酸在反应中做氧化剂
B . 这种“褪字灵”褪字原理和二氧化硫的漂白原理相同
C . 除色的离子方程式为2MnO  +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O
D . 每生成1molCO2 , 电子转移数为2NA
+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O
D . 每生成1molCO2 , 电子转移数为2NA
 +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O
D . 每生成1molCO2 , 电子转移数为2NA
+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O
D . 每生成1molCO2 , 电子转移数为2NA
中华文明上下五千年孕育了许多杰出的发明创造。下列不涉及氧化还原反应的是( )
A . 高粱酿酒
B . 青铜冶铸
C . 指南针的使用
D . 火药的爆炸
目前,汽车尾气系统中均安装催化转化器。在催化转化器中发生反应 2NO+2CO  2CO2+N2该反应中氧化剂是( )
2CO2+N2该反应中氧化剂是( )
 2CO2+N2该反应中氧化剂是( )
2CO2+N2该反应中氧化剂是( )
A . NO
B . N2
C . CO2
D . CO
下列有关物质分类或归类正确的一组是( )
①液氯、干冰、碘盐均为化合物 ②氯水、盐酸、水玻璃均为混合物 ③明矾、小苏打、纯碱均为电解质 ④牛奶、豆浆、石灰水均为胶体 ⑤  、
、  、
、  均为钠盐
均为钠盐
A . ①②
B . ②③
C . ③④
D . ②③⑤
下列对物质的分类正确的是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | NaOH | H2SO4 | BaCO3 | CuO | CO |
| B | Ba(OH)2 | HClO | KCl | Na2O2 | CO2 |
| C | Ca(OH)2 | HCl | CaCl2 | Na2O | SO2 |
| D | NaHCO3 | CH3COOH | Na2CO3 | CaO | NO2 |
A . A
B . B
C . C
D . D
铝土矿为自然界中铝的重要存在形式,通常含有50%左右的 , 以及
, 以及 、
、 和MgO等成分.上述4种氧化物中,属于两性氧化物的是( )
和MgO等成分.上述4种氧化物中,属于两性氧化物的是( )
 , 以及
, 以及 、
、 和MgO等成分.上述4种氧化物中,属于两性氧化物的是( )
和MgO等成分.上述4种氧化物中,属于两性氧化物的是( )
A .  B .
B .  C .
C .  D . MgO
D . MgO
 B .
B .  C .
C .  D . MgO
D . MgO
元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
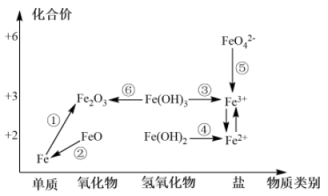
A . 铁与氧气的燃烧反应可实现上述①转化
B . 加热Fe(OH)3发生转化⑥,Fe2O3 加水溶解可转化为Fe(OH)3
C . 由图可预测:高铁酸盐(FeO )具有强氧化性,可用于饮用水的消毒
D . FeO是种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O3
)具有强氧化性,可用于饮用水的消毒
D . FeO是种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O3
 )具有强氧化性,可用于饮用水的消毒
D . FeO是种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O3
)具有强氧化性,可用于饮用水的消毒
D . FeO是种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe2O3
处理汽车尾气的反应2NO+2CO 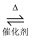 2CO2+N2中,还原剂是( )
2CO2+N2中,还原剂是( )
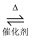 2CO2+N2中,还原剂是( )
2CO2+N2中,还原剂是( )
A . NO
B . CO
C . CO2
D . N2
纳米零价铁可用于去除水体中的六价铬[Cr(VI)]与硝酸盐等污染物。
-
(1) 用FeCl2溶液与NaBH4(H元素为-1价)溶液反应制备纳米零价铁的化学方程式:FeCl2+2NaBH4+6H2O=Fe+2B(OH)3+2NaCl+7H2↑,当生成1molFe时,转移电子的物质的量为。
-
(2) 纳米零价铁可将水体中Cr(VI)还原为Cr3+ , 再将Cr2+转化为Cr(OH)3(两性氢氧化物)从水体中除去。

①室温下Cr(VI)总浓度为0.20mol·L-1;溶液中,含铬物种浓度随pH的分布如图1所示。H2CrO4的Ka2=。
②调节溶液pH,可使Cr3+转化为Cr(OH)3 , 沉淀而被除去。但pH>9时,铬的去除率却降低,其原因是。
-
(3) 有人研究了用纳米零价铁去除水体中NO
 。
。 
①控制其他条件不变,用纳米零价铁还原水体中的NO
 ,测得溶液中NO
,测得溶液中NO  、NO
、NO  、NH
、NH  浓度随时间变化如图2所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(NO
浓度随时间变化如图2所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(NO  、NO
、NO  、NH
、NH  )浓度减少,其可能原因是。
)浓度减少,其可能原因是。②将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中NO
 ,其部分反应原理如图3所示,与不添加铜粉相比,添加少量铜粉时去除NO
,其部分反应原理如图3所示,与不添加铜粉相比,添加少量铜粉时去除NO  效率更高,其主要原因是;NO
效率更高,其主要原因是;NO  转化为NH
转化为NH  的机理可描述为。
的机理可描述为。
下列能正确表示反应的离子方程式的是( )
A . 稀盐酸与铁屑反应: B . 向硫酸钠溶液中加入氯化钡:
B . 向硫酸钠溶液中加入氯化钡: C . 向盐酸中滴加氨水:
C . 向盐酸中滴加氨水: D . 醋酸除去水垢:
D . 醋酸除去水垢:
 B . 向硫酸钠溶液中加入氯化钡:
B . 向硫酸钠溶液中加入氯化钡: C . 向盐酸中滴加氨水:
C . 向盐酸中滴加氨水: D . 醋酸除去水垢:
D . 醋酸除去水垢:
纳米氧化锌作为一种新型功能材料,在橡胶、涂料、陶瓷、防晒化妆品等领域广泛应用.以某烟道灰(主要成分为 , 另外含有少量
, 另外含有少量 等)为原料制备纳米
等)为原料制备纳米 的流程如图所示。已知常温时
的流程如图所示。已知常温时 。回答下列问题:
。回答下列问题:
 , 另外含有少量
, 另外含有少量 等)为原料制备纳米
等)为原料制备纳米 的流程如图所示。已知常温时
的流程如图所示。已知常温时 。回答下列问题:
。回答下列问题:
-
(1) 料渣Ⅱ的化学成分是
-
(2) 调
 加入的X可能是,相关的离子方程式包括:①
加入的X可能是,相关的离子方程式包括:① , ②
, ②
-
(3) 写出氧化过程中生成
 的离子方程式:
的离子方程式:
-
(4) 除铜原理为
 , 该反应的平衡常数K=
, 该反应的平衡常数K=
-
(5) 草酸锌晶体
 加热过程中固体质量随温度的变化情况如图所示
加热过程中固体质量随温度的变化情况如图所示
①图中A转化为B的过程中发生反应的化学方程式为
②实验室中证明得到的
 是纳米材料的方法是
是纳米材料的方法是
最近更新




