第二章 化学物质及其变化 知识点题库
 CH3COO-+Cu2O↓+3H2O
B . 向加碘食盐(含碘酸钾)中加入碘化钾溶液和稀硫酸:IO3-+I-+6H+=I2+3H2O
C . 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D . 亚硫酸钠水解:SO32-+2H2O
CH3COO-+Cu2O↓+3H2O
B . 向加碘食盐(含碘酸钾)中加入碘化钾溶液和稀硫酸:IO3-+I-+6H+=I2+3H2O
C . 偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D . 亚硫酸钠水解:SO32-+2H2O  H2SO3+2OH-
H2SO3+2OH-
 CH3COO-+
CH3COO-+  +2Ag↓+3NH3+H2O
B . 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C . 碳酸钠溶液加入过量的苯酚:2C6H5OH+
+2Ag↓+3NH3+H2O
B . 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C . 碳酸钠溶液加入过量的苯酚:2C6H5OH+  =2C6H5O-+CO2↑+H2O
D . 小苏打溶液和甲酸混合:
=2C6H5O-+CO2↑+H2O
D . 小苏打溶液和甲酸混合:  +HCOOH=COOH-+CO2↑+H2O
+HCOOH=COOH-+CO2↑+H2O
 与S2- 在酸性溶液中发生如下反应:M2O
与S2- 在酸性溶液中发生如下反应:M2O  +3S2-+14H+=2M3++3S↓+7H2O,则M2O
+3S2-+14H+=2M3++3S↓+7H2O,则M2O  中X为( )
中X为( )

-
(1) 通入足量SO2时C中观察到的现象为。
-
(2) 根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42−。该做法(填“合理”或“不合理”),理由是。
-
(3) 为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。A . 浓硫酸 B . 酸性KMnO4溶液 C . 碘水 D . NaCl溶液

回答下列问题:
-
(1) 浸出渣主要成分为(填化学式,下同) ;沉淀渣2为。
-
(2) “除铁锰"”时,Mn(II)氧化生成MnO2(
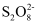 转化为
转化为  ),配平该反应的离子方程式Mn2++
),配平该反应的离子方程式Mn2++ 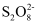 +H2O=MnO2↓+
+H2O=MnO2↓+  +H+ , 。
+H+ , 。
-
(3) “沉锌”时,反应的化学方程式为;检验Zn(OH)2∙ZnCO3已洗涤干净的方法是。
-
(4) “电解”中产生(填化学式)可在(填操作单元名称)中循环利用。
-
(5) 将Zn(OH)2∙ZnCO3加热分解可得到具有催化性能的活性氧化锌,若加热过程中固体质量减少了6. 2 kg,则理论上生成kg氧化锌。
 、Na+、Cl-、SO
、Na+、Cl-、SO  B . Cl-、NO
B . Cl-、NO  、Fe2+、H+
C . K+、Na+、SO
、Fe2+、H+
C . K+、Na+、SO  、MnO
、MnO  D . Na+、H+、NO
D . Na+、H+、NO  、HCO
、HCO 

已知:浸出液中的阳离子主要为Sb3+、Fe3+、Fe2+。
下列说法错误的是( )
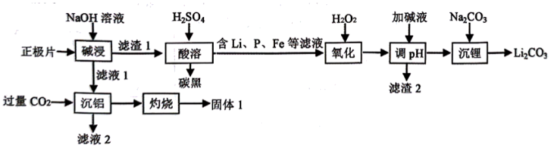
已知: I. 当离子浓度≤1.0×10-5 mol/L时,即认为该离子沉淀完全:
II.T℃时,Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
-
(1) “碱浸”的离子反应方程式是。
-
(2) “沉铝”所得滤液2中的物质 (填化学式) 经过处理可用于沉锂,从而实现联合生产;固体1常用法冶炼出金属。
-
(3) 加H2O2的目的是氧化,检验氧化已经完全的实验是;若将H2O2改为NaClO2也能达成目的,写出加NaClO2反应的离子方程式。
-
(4) “调pH”是使杂质离子形成氢氧化物而沉淀完全,溶液的pH值应不低于。
-
(5) 磷酸亚铁锂电池是一种具有较长使用寿命的二次电池,在充放电过程中表现出了良好的循环稳定性,放电时的总反应为:LixC6+Li1-xFePO4=6C+LiFePO4 , 则正极的电极反应式为。
 Fe(SCN)3K≈105
Fe(SCN)3K≈105
-
(1) i 中观察到的现象是,请结合化学用语用平衡移动原理进行解释。
-
(2) ii 中观察到溶液血红色变浅,接近无色,原因是铁粉参与了反应:,减小了 c(Fe3+),使平衡向逆反应方向移动。
-
(3) iii 中观察到溶液红色褪去,对此现象产生的原因进行探究:
①甲同学查阅文献后推测:草酸根(C2O
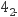 )具有还原性,可能与 Fe3+反应,产生一种气体,该气体的化学式是。
)具有还原性,可能与 Fe3+反应,产生一种气体,该气体的化学式是。②乙同学查阅文献后推测:Fe3+可能与 C2O
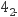 反应产生 Fe(C2O4)
反应产生 Fe(C2O4) (黄色)。
(黄色)。用灵敏试剂检验试管 iii 中产物,未检出 Fe2+ , 进一步论证后证实乙同学的推测较为合理。但是甲同学在 12 小时后检验 iii 中产物,检出了 Fe2+ , 对此现象的合理解释是。
-
(4) 实验 iv 是的对照实验。
a.实验i b.实验ii c.实验 iii
 、Cl-
B . 能使甲基橙显红色的溶液中:Zn2+、H+、ClO-、I-
C . 含0.1mol·L-1 NaHSO4的溶液:K+、Al3+、
、Cl-
B . 能使甲基橙显红色的溶液中:Zn2+、H+、ClO-、I-
C . 含0.1mol·L-1 NaHSO4的溶液:K+、Al3+、 、
、 D .
D .  =1.0×10-12的溶液:
=1.0×10-12的溶液:  、Na+、HCO
、Na+、HCO 、
、
 +Ba2++OH-=BaSO4↓+H2O
D . NO2通入水中制硝酸:2NO2+H2O=2H++NO
+Ba2++OH-=BaSO4↓+H2O
D . NO2通入水中制硝酸:2NO2+H2O=2H++NO  +NO
+NO
 )及其衍生物在工业上常用作还原剂、抗氧剂。制备水合肼的反应原理为
)及其衍生物在工业上常用作还原剂、抗氧剂。制备水合肼的反应原理为 , 若
, 若 过量,可将水合肼氧化生成
过量,可将水合肼氧化生成 。下列关于制备水合肼及相关反应的说法正确的是( )
。下列关于制备水合肼及相关反应的说法正确的是( )
 、
、 、
、 可以大量存在
B . 制备水合肼的反应中,
可以大量存在
B . 制备水合肼的反应中, 发生氧化反应
C .
发生氧化反应
C .  与水合肼的反应中,氧化剂与还原剂的物质的量之比为
与水合肼的反应中,氧化剂与还原剂的物质的量之比为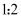 D .
D .  与盐酸反应的离子方程式为
与盐酸反应的离子方程式为
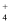 说法中正确的是( )
说法中正确的是( )
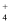 中含有配位键
C . SO3中硫原子轨道杂化类型为sp3
D . NH3为非极性分子
中含有配位键
C . SO3中硫原子轨道杂化类型为sp3
D . NH3为非极性分子
-
(1) 天然气中要加入少量有特殊气味的乙硫醇(
 ),
), 分子中S—H的极性小于
分子中S—H的极性小于 分子中O—H的极性,请解释其原因:。
分子中O—H的极性,请解释其原因:。
-
(2) 工业上采用
 催化还原
催化还原 , 不仅可以消除
, 不仅可以消除 污染,而且可得到有价值的单质S。反应分两步完成,如图所示,
污染,而且可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为。
第一步反应的化学方程式为。
-
(3) 燃煤烟气中含有
 和
和 , 工业上常用
, 工业上常用 溶液对燃煤烟气进行脱硫脱硝。已知
溶液对燃煤烟气进行脱硫脱硝。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
,  易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 或
或 。
。①在实验室模拟脱硫过程:调节
 吸收液的pH为5,向其中通入含
吸收液的pH为5,向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 , 则脱硫反应的离子方程式为。
, 则脱硫反应的离子方程式为。②在实验室模拟脱硝过程:调节
 吸收液的pH为5,向其中通入含NO的模拟烟气。测得脱硝效率(即NO的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是。
吸收液的pH为5,向其中通入含NO的模拟烟气。测得脱硝效率(即NO的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是。
③在实验室模拟同时脱硫、脱硝过程:调节
 吸收液的pH为5,向其中通入含
吸收液的pH为5,向其中通入含 和NO(体积比4:1)的模拟烟气。测得脱硫反应速率大于脱硝反应速率,原因是除了
和NO(体积比4:1)的模拟烟气。测得脱硫反应速率大于脱硝反应速率,原因是除了 和NO在烟气中的初始浓度不同,还可能是。
和NO在烟气中的初始浓度不同,还可能是。
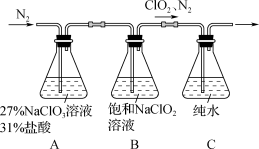
已知装置A中发生的反应:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl(主反应)
NaClO3+6HCl=NaCl+3Cl2↑+3H2O(副反应)
-
(1) 证明装置A中产生Cl2 , 是否可用湿润的淀粉碘化钾试纸:(填“是”或“否”)。
-
(2) Cl2在装置B的反应中主要体现氧化性,该反应的化学方程式为。
-
(3) 实验过程中不断缓慢通入N2的目的是。
-
(4) 单位体积ClO2吸收液中含有ClO2的质量的实验测定步骤如下:
步骤1:准确移取1.00 mL装置C中的吸收液加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O),在暗处放置5 min。
步骤2:向锥形瓶的反应液中加入1 mL溶液(填试剂名称),溶液呈蓝色,再向其中滴加0.08 mol·L-1 Na2S2O3溶液(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),至恰好完全反应时(蓝色褪去)消耗Na2S2O3溶液20.00 mL。
①步骤2中所加试剂名称是;
②计算装置C中,每1.00 mL ClO2吸收液中含有ClO2的质量(单位mg)(写出计算过程)。



