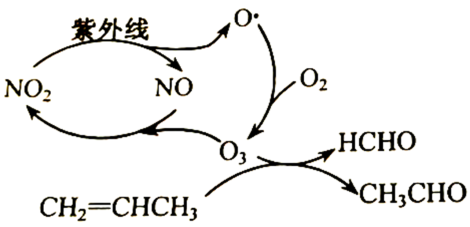
第三节 氧化还原反应 知识点题库
-
(1) 是化合反应又是氧化还原反应的.
-
(2) 是分解反应又是氧化还原反应的.
-
(3) 是氧化还原反应又是置换反应的.
-
(4) 写出酸性氧化物与可溶性碱反应的化学方程式.
-
(5) 写出碱性氧化物与水反应的化学方程式.
 Cu+H2O
B . CO2+Ca(OH)2
Cu+H2O
B . CO2+Ca(OH)2  CaCO3↓+H2O
C . Fe2O3+3CO═2Fe+3CO2
D . 2Na+Cl2═2NaCl
CaCO3↓+H2O
C . Fe2O3+3CO═2Fe+3CO2
D . 2Na+Cl2═2NaCl
 2AlN+3CO合成.下列叙述正确的是( )
2AlN+3CO合成.下列叙述正确的是( )
-
(1) 配平化学反应方程式并标出电子转移的方向和总数:
Fe(NO3)3 +NaOH + Cl2 → Na2FeO4 +NaNO3 + NaCl + H2O,
-
(2) 上述反应中元素被氧化,发生还原反应的物质是
-
(3) 写出铁元素在元素周期表中的位置是第周期第族
-
(4) 写出上述反应中还原产物的电子式
-
(5) 若反应中转移了0.1 mol电子,则消耗了L Cl2(标准状况)。
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al  Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C  SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B . 实验过程中两次用酸溶解,均需使用稀盐酸
C . KMnO4滴定草酸过程中,标准状况下每产生448mLCO2气体理论上转移0.02mole-
D . 滴定过程中若滴加KMnO4过快会发生反应4MnO
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
B . 实验过程中两次用酸溶解,均需使用稀盐酸
C . KMnO4滴定草酸过程中,标准状况下每产生448mLCO2气体理论上转移0.02mole-
D . 滴定过程中若滴加KMnO4过快会发生反应4MnO  +12H+=4Mn2++5O2↑+6H2O,将导致测定结果偏高
+12H+=4Mn2++5O2↑+6H2O,将导致测定结果偏高
-
(1) I.消除氮氧化物有多种方法:
用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ/mol
③H2O(g)=H2O(l)△H=-44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式。
-
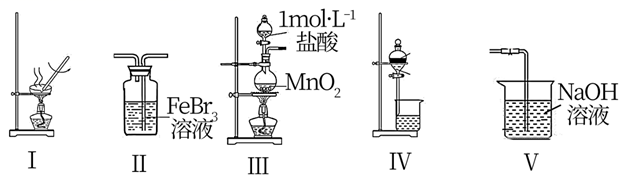
(2) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图所示:

①由图甲可知,SCR技术中的氧化剂为。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为。
-
(3) II.氮氧化物的相互转化
T1℃时,在一密闭容器中发生反应4NO(g)
 N2(g)+2NO2(g)△H<0,其正反应速率表达式为:v正=k正·cn(NO),测得反应速率和浓度的关系如下表。
N2(g)+2NO2(g)△H<0,其正反应速率表达式为:v正=k正·cn(NO),测得反应速率和浓度的关系如下表。
则k正=mol-3·L3·s-1。下列对于该反应的说法正确的是。
A.当混合物颜色保持不变时就达到了化学平衡状态
B.当
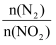 的比值保持不变时就达到了化学平衡状态
的比值保持不变时就达到了化学平衡状态C.达到化学平衡状态时,每消耗0.1 mol NO就会消耗NO20.05 mol
D.达到平衡后,若降低温度,则混合气体的颜色变浅
E.达到平衡后,若减小压强,则混合气体的平均相对分子质量将减小
-
(4) 利用测压法在刚性密闭容器中研究T2℃时4NO(g)
 N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示: 
①20min时,NO的转化率为。
②T2℃时,用平衡分压代替平衡浓度表示的平衡常数Kp=MPa-1。[已知:气体分压(P分)=气体总压(P总)×体积分数]

 2Fe3O4
B . 过程Ⅱ中H2为还原剂
C . 整个过程的总反应为:2H2O
2Fe3O4
B . 过程Ⅱ中H2为还原剂
C . 整个过程的总反应为:2H2O  2H2↑+O2↑
D . FeO 是过程Ⅰ的氧化产物
2H2↑+O2↑
D . FeO 是过程Ⅰ的氧化产物
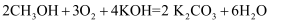 。下列说法正确的是( )
。下列说法正确的是( ) 
 ,此时乙池中银极增重3.2g
C . 甲池通入
,此时乙池中银极增重3.2g
C . 甲池通入  的电极反应为
的电极反应为  D . 反应一段时间后,向丙池中加入一定量盐酸,一定能使
D . 反应一段时间后,向丙池中加入一定量盐酸,一定能使 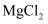 溶液恢复到原浓度
溶液恢复到原浓度