第三节 氧化还原反应 知识点题库
雌黄与浓硝酸反应如下:As2 S3+28HNO3(浓)=2H3AsO4 +3H2SO4+28NO2↑+8H2O,
下列说法正确的是( )
下列说法正确的是( )
A . 氧化产物只有H2SO4
B . 1mol As2S3发生反应,有28 mol电子转移
C . 该反应中As2S3既是氧化剂又是还原剂
D . As2S3不可能与氧气反应
如下图所示,离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是( )
A . 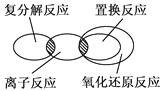 B .
B . 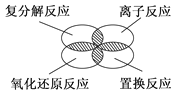 C .
C . 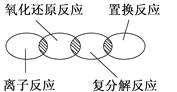 D .
D . 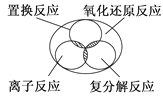
 B .
B .  C .
C .  D .
D . 
已知2Fe3++2I﹣═2Fe2++I2、Br2+2Fe2+═2Br﹣+2Fe3+ . 现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是( )
①按I﹣、Fe2+、Br﹣的顺序还原性逐渐减弱;
②原溶液中Br﹣一定被氧化;
③通入氯气后原溶液中Fe2+一定被氧化;
④不能确定通入氯气后的溶液中是否还存在Fe2+;
⑤若取少量所得溶液,加入CCl4充分振荡后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br﹣均被完全氧化.
A . ①②③④
B . ①③④⑤
C . ②④⑤
D . ①②③④⑤
实验室可以用KMnO4标准液滴定草酸(H2C2O4),测定溶液中草酸的浓度.判断下列说法不正确的是( )
A . 滴定中涉及的离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
B . KMnO4标准溶液常用硫酸酸化,若用HNO3酸化,会使测定结果偏低
C . KMnO4标准溶液盛放在酸式滴定管中
D . 该实验选择酚酞做指示剂,当待测液颜色由无色变为浅红色时即达到滴定终点
某反应为:4CuI+Hg=Cu2HgI4+2Cu (反应前后的I均为﹣1价),试回答:
①上述反应产物Cu2HgI4中,Hg元素显价;
②CuI发生反应(填氧化或还原).
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为( )
A . 2:1
B . 1:2
C . 3:1
D . 1:3
常温下在溶液中可发生以下反应: ①2Fe2++ Br2=2Fe3+ + 2Br− ②2Br−+ Cl2=Br2 + 2Cl− ③2Fe3+ + 2I−= 2Fe2++ I2。下列说法正确的是( )
A . 铁元素在反应①中被还原,在③中被氧化
B . 反应②中当有1 mol Cl2被氧化时,有2 mol 电子转移
C . 氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+
D . 还原性强弱顺序为:I− > Fe2+ > Br− > Cl−
某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
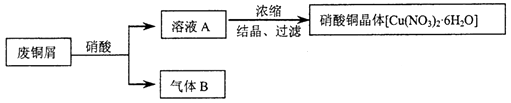
-
(1) 某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2 和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比。
②若测得溶液A中H+的浓度为1mol·L-1 , 则原硝酸的物质的量浓度为。(假设反应前后溶液的体积不变)
-
(2) 上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题。
下列变化原理不同于其他三项的是()
A . 将Na投入水中溶液呈碱性
B . Cl2能使品红褪色
C . 过氧化钠作供氧剂
D . 活性炭可作为净水剂
实验室常用NaNO2与NH4Cl反应制取N2。下列有关说法正确的是( )
A . NaNO2是还原剂
B . NH4Cl中N元素被还原
C . 生成1molN2时转移6mol电子
D . 氧化剂和还原剂的物质的量之比是1:1
铀(U)是一种稀有金属,制造氢弹的重要原料。提取铀涉及的反应为:UF4+
2Mg  U + 2MgF2。在该反应中,作为还原剂的物质是,被还原的物质是;若反应中消耗1 mol Mg,则生成Umol。
U + 2MgF2。在该反应中,作为还原剂的物质是,被还原的物质是;若反应中消耗1 mol Mg,则生成Umol。
 U + 2MgF2。在该反应中,作为还原剂的物质是,被还原的物质是;若反应中消耗1 mol Mg,则生成Umol。
U + 2MgF2。在该反应中,作为还原剂的物质是,被还原的物质是;若反应中消耗1 mol Mg,则生成Umol。
食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:  +5I-+6H+=3I2+3H2O 验证食盐中存在
+5I-+6H+=3I2+3H2O 验证食盐中存在  ,根据上述反应,下列说法错误的是( )
,根据上述反应,下列说法错误的是( )
 +5I-+6H+=3I2+3H2O 验证食盐中存在
+5I-+6H+=3I2+3H2O 验证食盐中存在  ,根据上述反应,下列说法错误的是( )
,根据上述反应,下列说法错误的是( )
A .  作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该反应下氧化性:
作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该反应下氧化性:  > I2
D . 每生成 3 个 I2转移 6 个电子
> I2
D . 每生成 3 个 I2转移 6 个电子
 作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该反应下氧化性:
作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该反应下氧化性:  > I2
D . 每生成 3 个 I2转移 6 个电子
> I2
D . 每生成 3 个 I2转移 6 个电子
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A . Cu2+、K、HCl
B . Cl2、Al、H2
C . NO2、Na、Cl2
D . O2、SO2、H2O
根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向0.1 mol/LFeCl2溶液中加入几滴氯水,溶液颜色变成棕黄色 | 氯水中含有HClO |
| B | 用pH试纸测得浓度均为0.1 mol/L的CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 | CH3COOH电离出H+的能力比HNO2的强 |
| C | 向3 mol KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色 | Br2的氧化性比I2的强 |
| D | 向浓度均为0.05 mol/L的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
A . A
B . B
C . C
D . D
下列说法正确的是( )
A . 标准状况下, 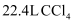 含有的分子数约为
含有的分子数约为 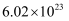 B .
B .  含有的中子数约为
含有的中子数约为 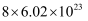 C .
C .  和
和  的混合物中含有的氮原子数共约为
的混合物中含有的氮原子数共约为 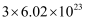 D .
D . 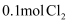 与足量的
与足量的  反应转移的电子数约为
反应转移的电子数约为 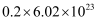
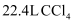 含有的分子数约为
含有的分子数约为 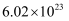 B .
B .  含有的中子数约为
含有的中子数约为 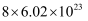 C .
C .  和
和  的混合物中含有的氮原子数共约为
的混合物中含有的氮原子数共约为 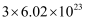 D .
D . 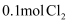 与足量的
与足量的  反应转移的电子数约为
反应转移的电子数约为 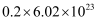
某化学兴趣小组用如图所示装置检验Pb(NO3)2受热分解的产物(图中夹持和加热设备略去)。在试管中放入研碎的Pb(NO3)2晶体后,加热;实验结束后,试管中得到黄色粉末(PbO),U形管下部有少量液体X,集气瓶中收集到无色气体Y。下列说法错误的是( )
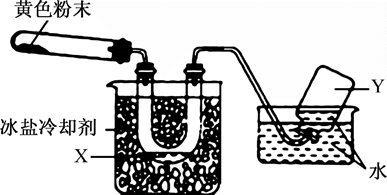
A . 液体X可能是液化的NO2或N2O4 ,
B . 在装置中用锡纸将胶塞、胶管与产生的气体隔开,主要是为了防止其被生成的气体腐蚀。
C . 气体Y可能是O2 , 也可能是NO2与水反应后生成的NO
D . 停止反应,应注意先把导气管移出水面,然后熄灭火焰
下列叙述不涉及氧化还原反应的是( )
A . 食物腐败变质
B . 对电力不足的新能源汽车充电
C . 用SO2漂白纸浆
D . 苯酚放置在空气中变为粉红色
下列离子方程式正确的是( )
A . 向NaClO溶液中通入 B . 惰性电极电解氯化镁溶液:
B . 惰性电极电解氯化镁溶液: C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水:
C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水: D . 硫酸铁溶液与亚硫酸钠溶液混合:
D . 硫酸铁溶液与亚硫酸钠溶液混合: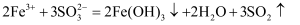
 B . 惰性电极电解氯化镁溶液:
B . 惰性电极电解氯化镁溶液: C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水:
C . 侯氏制碱法的原理是将二氧化碳和氨气通入饱和食盐水: D . 硫酸铁溶液与亚硫酸钠溶液混合:
D . 硫酸铁溶液与亚硫酸钠溶液混合: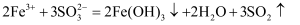
将两份质量均为5.4g的Al分别投入到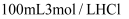 溶液和
溶液和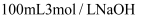 溶液中,充分反应后,生成
溶液中,充分反应后,生成 物质的量之比为( )
物质的量之比为( )
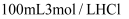 溶液和
溶液和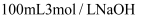 溶液中,充分反应后,生成
溶液中,充分反应后,生成 物质的量之比为( )
物质的量之比为( )
A . 1∶1
B . 1∶2
C . 1∶3
D . 1∶4
K2FeO4具有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4 , 其制备的流程如下:
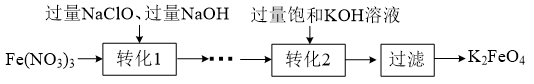
已知:K2FeO4能溶于水,微溶于浓KOH溶液,“转化1”时有 生成。下列有关说法正确的是( )
生成。下列有关说法正确的是( )
A . K2FeO4中铁元素的化合价是+3
B . “转化1”发生反应的离子方程式为:2Fe3++3ClO-+5H2O=2 +3Cl-+10H+
C . “转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小
D . 所得滤液含有大量的Na+、H+、
+3Cl-+10H+
C . “转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小
D . 所得滤液含有大量的Na+、H+、 、Cl-
、Cl-
 +3Cl-+10H+
C . “转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小
D . 所得滤液含有大量的Na+、H+、
+3Cl-+10H+
C . “转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小
D . 所得滤液含有大量的Na+、H+、 、Cl-
、Cl-
最近更新



