第三节 氧化还原反应 知识点题库
下列说法正确的是( )
A . 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
B . 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱
C . 在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解
D . 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I‑
某容器中发生一个化学反应,反应过程中存在H2O、ClO﹣、CN﹣、HCO3﹣、N2、Cl﹣六种物质.在反应过程中测得ClO﹣和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
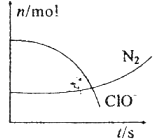
A . 还原剂是含CN﹣的物质,氧化产物不只有N2
B . 氧化剂是ClO﹣ , 还原产物是HCO3﹣
C . 配平后氧化剂与还原剂的化学计量数之比为5:2
D . 若生成2.24LN2则转移电子1mol
下列既属于氧化还原反应,又属于吸热反应的是( )
A . 铝片与稀盐酸反应
B . 灼热的炭与水蒸气的反应
C . Ba(OH)2•8H2O与NH4Cl反应
D . 甲烷在氧气中的燃烧反应
已知还原性:SO2>I->Fe2+ , 下列离子反应不能发生的是( )
A . SO2 + 2Fe3+ + 2H2O = 2Fe2+ + SO42- + 4H+
B . I2 + 2Fe2+ = 2I- + 2Fe3+
C . SO2 + Cl2 + 2H2O= 2Cl- + SO42- + 4H+
D . 少量Cl2通入FeI2溶液中:Cl2 + 2I- =I2+2Cl—
15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为( )
A . 4 mol·L-1
B . 3 mol·L-1
C . 2 mol·L-1
D . 1mol·L-1
设NA代表阿伏加德罗常数的值,下列有关说法正确的是 



A . 60g冰醋酸晶体中,含阴离子数目为NA
B . 标准状况下,22.4LCCl4中含有分子的数目为NA
C . 常温下,46gNO2与N2O4混合气体中含分子数为NA
D . 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
-
(1) Ⅰ. 某厂废水中含有KCN,其浓度为0.1mol/L ,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):KCN+2KOH+Cl2=KOCN+2KCl +H2O
上述反应中被氧化的元素是(用元素符号表示)。
-
(2) 投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+Cl2+=K2CO3 +N2+ KCl +。
-
(3) 若将10L含KCN的浓度为0.01mol/L 的废水中KCN氧化为N2除去,最少需要氯气 mol。
-
(4) Ⅱ. 某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
现实验室需用80mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需 ;
-
(5) Na2S2O3还原性较强,在溶液中易被Cl2氧化为SO42- , 因此Na2S2O3常用作脱氯剂,该反应的离子方程式为 。
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
A . 2NaBr+Cl2=2NaCl+Br2
B . AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C . 2H2S+SO2=2H2O+3S↓
D . C+H2O=CO+H2
NO2与水的反应可表示为:3NO2+H2O=2HNO3+NO,关于此反应的下列说法中正确的是( )
A . 氮元素的化合价没有发生变化
B . NO2只是氧化剂
C . NO2只是还原剂
D . NO2既是氧化剂,又是还原剂
X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第ⅦA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。请回答下列问题:
-
(1) R外围原子(即价电子)的电子排布式是。
-
(2) 利用价层电子对互斥理论判断RU4分子的立体构型是。
-
(3) R所在周期元素最高价氧化物对应的水化物中,酸性最强的 (填化学式);Z和U的氢化物中沸点较低的是 (填化学式);Q、R、U的单质形成的晶体,熔点由低到高的排列顺序是 (填化学式)。
-
(4) CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是。
已知黑火药爆炸的反应:S+2KNO3+3C → K2S+3CO2+ N2↑,下列说法正确的是( )
A . 该反应中氧化剂只有硝酸钾
B . 该反应中还原剂只有碳
C . 每生成0.1 mol N2转移电子1 mol
D . 产物中有两种共价化合物
含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6ClF3=6CoF3+3Cl2+4X。下列有关该反应的说法,正确的是( )
A . X与O3互为同位素
B . 1 mol Co3O4在反应中转移9 mol电子
C . ClF3中氯元素为-3价
D . Co3O4在反应中作氧化剂
下列实验操作和现象所得出的结论均正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴加几滴 | 该过程未发生氧化还原反应 |
| B | 在各盛5mL 1mol/L NaOH溶液的两支试管中,分别滴入5滴1mol/L | |
| C | 配制 | 抑制 |
| D | 向酸性含碘废水中加入淀粉溶液,然后滴入少量 | 该废水中可能含 |
A . A
B . B
C . C
D . D
下列有关说法正确的是( )
A . 溶液、胶体和浊液的本质区别是能否发生丁达尔效应
B . 氧化物是指含有氧元素的化合物
C . 氧化还原反应与非氧化还原反应的区别是元素化合价是否变化
D . 电解质与非电解质的区别是物质溶于水形成的溶液是否导电
古籍中记载的下列事实或现象的形成,未涉及氧化还原反应的是( )
A . 《梦溪笔谈》:“石穴中水,所滴者皆为钟乳”
B . 《神农本草经》:“空青(蓝铜矿类)…能化铜铁鉉(铅)锡作金”
C . 《本草纲目》:“野外之鬼磷,其火色青,其状如炬,俗称鬼火…”
D . 《本草经疏》:“丹砂(HgS),味甘微寒而无毒…若经伏火…,则毒等砒硇,服之必毙”
已知氧化性:Cl2>Fe3+>Cu2+>H+ , 下列化学反应或离子反应不能发生的是( )
A . Cu+2H+=Cu2++H2↑
B . Cl2 +2FeCl2=2FeCl3
C . Cu+Cl2=CuCl2
D . 2Fe3++Cu=2Fe2++Cu2+
白磷(P4)通常是白色或黄色蜡状固体,几乎不溶于水,易溶于有机溶剂,可与热的浓碱反应,其反应的化学方程式为P4+3NaOH+3H2O=3NaH2PO2+PH3↑。次磷酸钠(NaH2PO2)是一种正盐,水溶液呈碱性(设NA为阿伏加德罗常数的值)。下列有关说法正确的是( )
A . H3PO2是一元弱酸
B . 生成1molPH3时,有4NAP—P键断裂
C . 次磷酸钠的水溶液呈碱性的原因是H2PO  的水解大于H2PO
的水解大于H2PO  的电离
D . 白磷与热的浓碱反应时,氧化剂和还原剂的物质的量之比为3∶1
的电离
D . 白磷与热的浓碱反应时,氧化剂和还原剂的物质的量之比为3∶1
 的水解大于H2PO
的水解大于H2PO  的电离
D . 白磷与热的浓碱反应时,氧化剂和还原剂的物质的量之比为3∶1
的电离
D . 白磷与热的浓碱反应时,氧化剂和还原剂的物质的量之比为3∶1
汽车尾气处理系统中的“催化转化器”,能使尾气中的 CO与 NO反应转化成可参与大气生态循环的无毒气体,反应的化学方程式为  ,关于该反应的说法正确的是( )
,关于该反应的说法正确的是( )
 ,关于该反应的说法正确的是( )
,关于该反应的说法正确的是( )
A . CO发生还原反应
B . 每生成 1mol N2 , 转移 2mol电子
C . NO是氧化剂,被氧化
D . CO2是氧化产物
实验室常用NH4Cl(饱和)与NaNO2(饱和)加热制备N2。
-
(1) 该制备反应的离子方程式为。
-
(2) 用该方法制得的N2气中常含有H2O、NO、O2、NH3等杂质,请分别写出除去O2和NH3所用的化学物质,O2:;NH3。
-
(3) 上述除杂实验装置中,除去杂质的装置应该放在最后一步。
贫血是一种常见的疾病,其中缺铁性贫血是贫血中最常见的类型,通常补铁剂会与维生素C同服。下列有关叙述中错误的是( )
A . 补铁剂中的铁以Fe3+形式存在
B . 铁是人体必需的微量元素
C . 补铁剂搭配的维生素C具有还原性
D . Fe2+具有还原性,能被氧化成Fe3+
最近更新
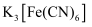
 溶液和1mol/L
溶液和1mol/L 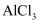 溶液,前者有红褐色沉淀生成,后者无沉淀生成
溶液,前者有红褐色沉淀生成,后者无沉淀生成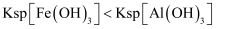
 水解
水解 溶液,废水立刻变蓝色
溶液,废水立刻变蓝色



